题目内容
关于SO2的叙述,正确的是
- A.它可使石蕊试液褪色
- B.等物质的量的Cl2和SO2通入品红溶液中,品红溶液不褪色
- C.它能与BaCl2溶液反应生成BaSO3沉淀
- D.它与水作用生成H2SO4
B
分析:A.根据SO2的漂白性有一定的选择性,不能漂白石蕊等;
B、根据SO2具有还原性,能被氯气所氧化;
C、根据强酸制取弱酸的原理来分析;
D、根据SO2与水发生化合反应;
解答:A.因SO2的漂白性有一定的选择性,不能漂白石蕊,二氧化硫能和水反应生成亚硫酸,所以二氧化硫通入紫色石蕊试液只变红后不褪色,故A错误;
B、因SO2具有还原性,能被氯气所氧化:SO2+Cl2+2H20=H2SO4+2HCl,H2SO4和HCl都不能使品红溶液褪色,故B正确;
C、因HCl的酸性强于H2SO3,所以H2SO3和BaCl2不能反应生成BaSO3和盐酸,故C错误;
D、SO2与水发生化合反应生成H2SO3,故D错误;
故选B.
点评:本题考查二氧化硫的性质,需要注意的是氧化硫具有漂白性、但二氧化硫的漂白具有选择性.
分析:A.根据SO2的漂白性有一定的选择性,不能漂白石蕊等;
B、根据SO2具有还原性,能被氯气所氧化;
C、根据强酸制取弱酸的原理来分析;
D、根据SO2与水发生化合反应;
解答:A.因SO2的漂白性有一定的选择性,不能漂白石蕊,二氧化硫能和水反应生成亚硫酸,所以二氧化硫通入紫色石蕊试液只变红后不褪色,故A错误;
B、因SO2具有还原性,能被氯气所氧化:SO2+Cl2+2H20=H2SO4+2HCl,H2SO4和HCl都不能使品红溶液褪色,故B正确;
C、因HCl的酸性强于H2SO3,所以H2SO3和BaCl2不能反应生成BaSO3和盐酸,故C错误;
D、SO2与水发生化合反应生成H2SO3,故D错误;
故选B.
点评:本题考查二氧化硫的性质,需要注意的是氧化硫具有漂白性、但二氧化硫的漂白具有选择性.

练习册系列答案
相关题目
关于工业生产的下列叙述,正确的是( )
A、氯碱厂电解饱和食盐水溶液制取NaOH,为了有效地除去粗盐水中Ca2+、Mg2+、
| ||
| B、在接触法制硫酸的工业生产中,SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率 | ||
| C、以石灰石、纯碱、石英为原料,在玻璃窑中加强热制取普通玻璃 | ||
| D、合成氨生产过程中将NH3液化分离,可增大正反应速率,提高N2、H2的转化率 |
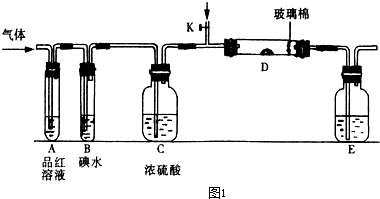
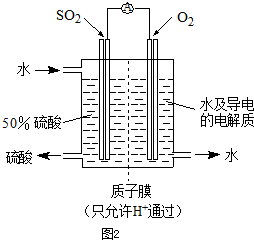

 入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的
入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的 是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。 酸 C.硝酸钾溶
酸 C.硝酸钾溶 液 D.硫化钠溶液
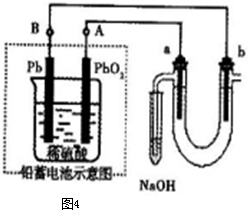
液 D.硫化钠溶液 l2与含X的溶液反应的离子方程式 。
l2与含X的溶液反应的离子方程式 。

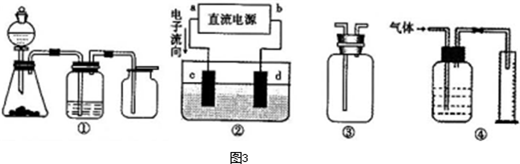
 ,a为正扳,d为阳极
,a为正扳,d为阳极 2、NH3、Cl2,、HCl、NO2等
2、NH3、Cl2,、HCl、NO2等 .装置④能用于测量气体体积
.装置④能用于测量气体体积



