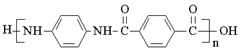题目内容
【题目】0.1000mol·L-1的H3PO4溶液用0.1000mol·L-1的NaOH溶液进行滴定,其滴定曲线如下图所示[已知:滴定分数a=n(滴定液中溶质)/n(被滴定溶质)]。下列说法正确的是

A. n=1时,c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-)
B. n=1.5时,2c(Na+)>3c(H3PO4)+3c(HPO42-)
C. n=2时,c(Na+)>c(HPO42-)>c(PO43-)>c(H2PO4-)
D. n=3时,c(OH-)=c(H+)+c(HPO42-)+c(H2PO4-)+c(H3PO4)
【答案】B
【解析】
A.n=1时,表示H3PO4与NaOH按1:1反应,恰好生成NaH2PO4,溶液为酸性,说明H2PO4-的电离程度大于其水解程度,则溶液中c(HPO42-)>c(H3PO4),故A错误;B.n=1.5时,反应恰好生成等量的NaH2PO4和Na2HPO4,溶液中存在物料守恒:2c(Na+)=3c(H3PO4)+3c(HPO42-)+3c(H2PO4-)+3c(PO43-),所以有2c(Na+)>3c(H3PO4)+3c(HPO42-),故B正确;C.n=2时,反应恰好生成Na2HPO4,溶液呈碱性,HPO4-的水解程度大于其电离程度,则溶液中c(H2PO4-)>c(PO43-),故C错误;D.n=3时,反应恰好生成Na3PO4,溶液呈碱性,根据质子守恒:c(OH-)=c(H+)+c(HPO42-)+2c(H2PO4-)+3c(H3PO4),故D错误;故选B。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
【题目】在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)![]()
![]()
![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)右图表示NO2的变化的曲线是_______。用O2表示从0~2 s内该反应的平均速率v=_______________。
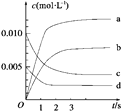
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂