题目内容
【题目】下列试剂中,能用于检验酒精中是否有水的是( )
A. 金属钠;B. 浓硫酸C. CuSO4·5H2OD. 无水硫酸铜
【答案】D
【解析】
A、钠与乙醇、水都反应生成氢气,也不能鉴别,选项A错误;
B、向酒精中加入浓硫酸与向水中加入浓硫酸的现象相似,不能鉴别,选项B错误;
C、向酒精中加入胆矾,没有能够说明有水存在的现象发生,不能鉴别,选项C错误;
D、水和与硫酸铜反应生成蓝色五水硫酸铜晶体,可鉴别,选项D正确;
答案选D。

 口算题天天练系列答案
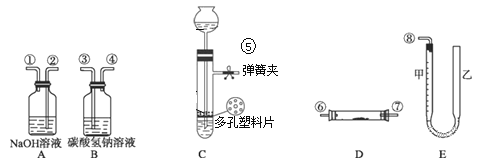
口算题天天练系列答案【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) 
选项 | ①中物质 | ②中物质 | 预测中的现象 |
A | 稀盐酸 | 碳酸钠、氢氧化钠混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.A
B.B
C.C
D.D
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫. 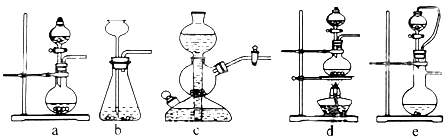
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是(填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰﹣石膏法和碱法是常用的烟气脱硫法.
石灰﹣石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO42H2O.其流程如图1,碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图2: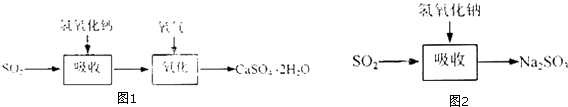
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰﹣石膏法和碱法吸收二氧化硫的化学原理相同之处是 . 和碱法相比,石灰﹣石膏法的优点是 , 缺点是 .
(4)在石灰﹣石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
【题目】工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
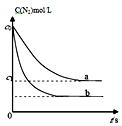
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 判断平衡移动的方向是(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为 .
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | P2 | P3 | |
则Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”下同):2p2p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2 , 一段时间又达到平衡时,B的体积为L(连通管中气体体积不计).