题目内容
 右图为周期表中短周期的一部分,若a原子的最外层上有5个电子,则下列说法中不正确的是( )
右图为周期表中短周期的一部分,若a原子的最外层上有5个电子,则下列说法中不正确的是( )分析:图为周期表中短周期的一部分,d处于第二周期,a、b、c处于第三周期,a原子的最外层上有5个电子,则a为P元素,b为S元素,c为Cl元素,d为O元素.
A、氧气有强氧化性,硫化氢有较强的还原性,二者能发生氧化还原反应;
B、同周期主族元素自左而右,原子半径减小;
C、非金属越强,氢化物越稳定.同周期主族元素自左而右,非金属性增强;
D、非金属越强,最高价氧化物的水化物的酸性越强,同周期主族元素自左而右,非金属性增强.
A、氧气有强氧化性,硫化氢有较强的还原性,二者能发生氧化还原反应;
B、同周期主族元素自左而右,原子半径减小;
C、非金属越强,氢化物越稳定.同周期主族元素自左而右,非金属性增强;
D、非金属越强,最高价氧化物的水化物的酸性越强,同周期主族元素自左而右,非金属性增强.
解答:解:图为周期表中短周期的一部分,d处于第二周期,a、b、c处于第三周期,a原子的最外层上有5个电子,则a为P元素,b为S元素,c为Cl元素,d为O元素.
A、d为O元素,b为S元素,氧气与硫化氢的水溶液反应2H2S+O2═2S↓+2H20,故A正确;
B、同周期主族元素自左而右,原子半径减小,所以原子半径a>b>c,故B正确;
C、同周期主族元素自左而右,非金属性增强,所以非金属性a<b,非金属越强,氢化物越稳定,所以b的氢化物比a的氢化物稳定,故C正确;
D、同周期主族元素自左而右,非金属性增强,所以非金属性a<b,非金属越强,最高价氧化物的水化物的酸性越强,所以a的最高价氧化物的水化物比b的最高价氧化物的水化物酸性弱,故D错误.
故选D.
A、d为O元素,b为S元素,氧气与硫化氢的水溶液反应2H2S+O2═2S↓+2H20,故A正确;
B、同周期主族元素自左而右,原子半径减小,所以原子半径a>b>c,故B正确;
C、同周期主族元素自左而右,非金属性增强,所以非金属性a<b,非金属越强,氢化物越稳定,所以b的氢化物比a的氢化物稳定,故C正确;
D、同周期主族元素自左而右,非金属性增强,所以非金属性a<b,非金属越强,最高价氧化物的水化物的酸性越强,所以a的最高价氧化物的水化物比b的最高价氧化物的水化物酸性弱,故D错误.
故选D.
点评:本题以元素周期表的结构为载体,考查元素推断、元素周期律、物质性质,难度不大,清楚周期表的结构是解题的关键.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
右图为周期表中短周期的一部分,若A原子的最外电子层上有5个电子,则下列说法中不正确的是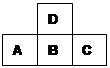
| A.C的单质可跟B的氢化物的水溶液反应 |
| B.原子半径A>B>C |
| C.D的氢化物比B的氢化物稳定 |
| D.A的高价氧化物对应水化物比B的高价氧化物对应水化物的酸性强 |
右图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是(双选)( )
|
|
d |
|
|
a |
b |
c |
A.a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a
B.a的氢化物比d的氢化物稳定
C.a和d的原子结合可以形成带3个负电荷的阴离子
D.原子半径大小顺序是c>b>d>a
 右图为周期表中短周期的一部分,若A原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
右图为周期表中短周期的一部分,若A原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )