题目内容
已知水的电离平衡曲线如图所示,试回答下列问题:
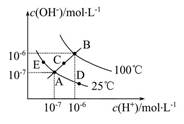
(1)图中五点Kw间的关系是 。
(2)若从A点到D点,可采用的措施是 。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。

(1)图中五点Kw间的关系是 。
(2)若从A点到D点,可采用的措施是 。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。
(1)B>C>A=D=E (2)b、c (3)10∶1
(1)Kw只与温度有关,温度升高促进水的电离,Kw增大,因此有B>C>A=D=E。
(2)从A点到D点,溶液由中性转化为酸性,因此选项b和c均符合题意。
(3)25 ℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)×10-5 mol/L=V(H2SO4)×10-4 mol/L,得V(NaOH)∶V(H2SO4)=10∶1。
(2)从A点到D点,溶液由中性转化为酸性,因此选项b和c均符合题意。
(3)25 ℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)×10-5 mol/L=V(H2SO4)×10-4 mol/L,得V(NaOH)∶V(H2SO4)=10∶1。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目

 H++OH-
H++OH-  H>0,下列叙述正确的是( )
H>0,下列叙述正确的是( )

 相等
相等