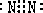题目内容
已知在加热的条件下浓硫酸能将碳单质氧化生成CO2和少量CO,而浓硫酸本身被还原成SO2,已知混合气体中CO2的量是CO的5倍.
(1)写出该反应的化学方程式:________.
(2)若用如图所示装置证明H2SO4的还原产物为SO2,碳的氧化产物之一有CO2,则装置连接顺序为(填装置的管口编号)________(所有装置不一定全选用,也可重复选用).

(3)按上述(2)连接进行实验,仍存在一个明显不足:________,试用文字表述改进方法:________.
答案:
解析:
解析:
|
答案:(1)6C+11H2SO4(浓) (2)i e f h g e f c d (3)未对尾气中的CO进行燃烧处理 于末端燃烧除去CO 思路解析:(1)配平此反应是关键,从题中知CO2和CO物质的量之比为5∶1,设生成5 mol CO2和1 mol CO,则共失去电子22 mol,必将有11 mol H2SO4得到电子生成11 mol SO2,所以化学方程式可以写成为:6C+11H2SO4(浓) |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目