题目内容
(2009?广州二模)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水.制备碘酸钙的实验流程如下.中间产物碘酸氢钾的合成原理为:I2+2KClO3+HCl
KH(IO3)2+KCl+Cl2↑,回答下列问题:

(1)制备碘酸氢钾的实验装置(支撑仪器太加热装置略去)如图,请在方框中补充必要的装置图并注明试剂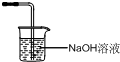

(2)若为上图增加加热装置,所需仪器除铁架台(带铁圈)、石棉网外还有
(3)实验中判断碘反应完全的实验现象是
(4)“调pH至10”的目的是
(5)加入CaCl2时反应的化学议程式为
(6)从水溶液中分离出碘酸钙时,可能得到无水盐、一水合物等,本实验得到的产品是Ca(IO3)2?6H2O,上述流程中与此结果密切相关的步骤是
| ||

(1)制备碘酸氢钾的实验装置(支撑仪器太加热装置略去)如图,请在方框中补充必要的装置图并注明试剂


(2)若为上图增加加热装置,所需仪器除铁架台(带铁圈)、石棉网外还有
酒精灯、烧杯、温度计
酒精灯、烧杯、温度计
.(3)实验中判断碘反应完全的实验现象是
反应混合溶液变为无色
反应混合溶液变为无色
.(4)“调pH至10”的目的是
将KH(IO3)2转化为KIO3
将KH(IO3)2转化为KIO3
.(5)加入CaCl2时反应的化学议程式为
KIO3+CaCl2=Ca(IO3)2+2KCl
KIO3+CaCl2=Ca(IO3)2+2KCl
.(6)从水溶液中分离出碘酸钙时,可能得到无水盐、一水合物等,本实验得到的产品是Ca(IO3)2?6H2O,上述流程中与此结果密切相关的步骤是
冰水中静置
冰水中静置
.分析:(1)制备碘酸氢钾的反应过程中生成有毒气体氯气不能排放到空气中,需要用氢氧化钠溶液吸收;
(2)反应保持在85°C左右,需要水浴加热,加热有酒精灯,温度计;
(3)依据化学反应反应物、生成物特征性质分析判断,反应中只有碘单质有颜色,根据颜色变化判断反应是否完全;
(4)碘酸钙是微溶于水的物质,加入氯化钙可以生成碘酸钙沉淀;
(5)物质溶解度随温度升高增大,随温度降低减小,冰水中冷却有利于碘酸钙析出晶体.
(2)反应保持在85°C左右,需要水浴加热,加热有酒精灯,温度计;
(3)依据化学反应反应物、生成物特征性质分析判断,反应中只有碘单质有颜色,根据颜色变化判断反应是否完全;
(4)碘酸钙是微溶于水的物质,加入氯化钙可以生成碘酸钙沉淀;
(5)物质溶解度随温度升高增大,随温度降低减小,冰水中冷却有利于碘酸钙析出晶体.
解答:解:(1)中间产物碘酸氢钾的合成原理为:I2+2KClO3+HCl
KH(IO3)2+KCl+Cl2↑,反应过程中生成有毒气体氯气不能排放到空气中,需要用氢氧化钠溶液吸收,装置图为 ,故答案为:
,故答案为: ;
;
(2)依据流程分析制备反应需要保持温度再85°C左右需要用水浴加热,用温度计控制温度高低,水浴需要的仪器有酒精灯、烧杯、温度计,
故答案为:酒精灯、烧杯、温度计(或恒温电炉);
(3)I2+2KClO3+HCl
KH(IO3)2+KCl+Cl2↑,依据反应可知碘单质反应完全后生成无色物质,所以反应后溶液变化为无色证明反应完全,
故答案为:反应混合溶液变为无色;
(4))“调pH至10”的目的是加入氢氧化钾和碘酸氢钾反应生成KIO3,故答案为:将KH(IO3)2转化为KIO3;
(5)流程中加入氯化钙会和碘酸钾发生反应生成碘酸钙,发生的反应为:KIO3+CaCl2=Ca(IO3)2+2KCl,故答案为:KIO3+CaCl2=Ca(IO3)2+2KCl;
(6)从水溶液中分离出碘酸钙时,可能得到无水盐、一水合物等,其中加入绿化钙后冰水冷却便于晶体析出,过滤水洗、乙醇洗得到结晶水合物,
故答案为:冰水中静置.
| ||
 ,故答案为:
,故答案为: ;
;(2)依据流程分析制备反应需要保持温度再85°C左右需要用水浴加热,用温度计控制温度高低,水浴需要的仪器有酒精灯、烧杯、温度计,
故答案为:酒精灯、烧杯、温度计(或恒温电炉);
(3)I2+2KClO3+HCl
| ||
故答案为:反应混合溶液变为无色;
(4))“调pH至10”的目的是加入氢氧化钾和碘酸氢钾反应生成KIO3,故答案为:将KH(IO3)2转化为KIO3;
(5)流程中加入氯化钙会和碘酸钾发生反应生成碘酸钙,发生的反应为:KIO3+CaCl2=Ca(IO3)2+2KCl,故答案为:KIO3+CaCl2=Ca(IO3)2+2KCl;
(6)从水溶液中分离出碘酸钙时,可能得到无水盐、一水合物等,其中加入绿化钙后冰水冷却便于晶体析出,过滤水洗、乙醇洗得到结晶水合物,
故答案为:冰水中静置.
点评:本题考查了物质制备实验操作的分析判断,物质性质的分析,信息应用能力,流程分析判断是解题关键,注意知识积累,题目难度中等.

练习册系列答案
相关题目