题目内容
(2012?唐山三模)下图是元素周期的一部分,按要求回答下列问题.

(1)Fe在元素周期表中位于
(2)写出由元素①、⑥形成的既含极性键又含非极键的化合物的结构式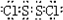
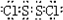 .
.
(3)A、B、C、D、E、X是由上表给出的元素组成的单质或化合物,存在如下转化关系(部分生成物和反应条件已略去).

若E为氧化物,X为单质,则A与水反应的离子方程式为
(4)以葡萄糖为燃料的微生物燃料电池结构示意图如下,写出该电池的负极反应
 .
.

(1)Fe在元素周期表中位于
四
四
周期,VIII
VIII
族.(2)写出由元素①、⑥形成的既含极性键又含非极键的化合物的结构式
H-O-O-H
H-O-O-H
;M是由⑦、⑧元素形成的四原子分子,其各元素原子的最外层电子数满足8电子稳定结构,写出M的电子式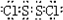
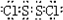
(3)A、B、C、D、E、X是由上表给出的元素组成的单质或化合物,存在如下转化关系(部分生成物和反应条件已略去).

若E为氧化物,X为单质,则A与水反应的离子方程式为
3NO2+H2O=2H++2NO3-+NO
3NO2+H2O=2H++2NO3-+NO
,写出由B生成C的化学方程式Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
,当生成D的物质的量为0.3mol时,理伦上至少消耗A1.2
1.2
mol.(4)以葡萄糖为燃料的微生物燃料电池结构示意图如下,写出该电池的负极反应
C6H12O6+6H2O-24e-=6CO2+24H+
C6H12O6+6H2O-24e-=6CO2+24H+
 .
.分析:由元素在周期表中的位置可知①为H元素,②为Na元素,③为Al元素,④为C元素,⑤为N元素,⑥为O元素,⑦为Cl元素,⑧为S元素,⑨为Fe元素,
在常温下能与水反应生成氧化物的反应为NO2与水的反应,生成NO和HNO3,则A为NO2,B为HNO3,E为NO,X能与硝酸发生连续的反应,应为变价金属,应为Fe,则C为Fe(NO3)3,D为Fe(NO3)2,
以葡萄糖为燃料的微生物燃料电池,负极发生葡萄糖的氧化反应,生成二氧化碳气体,以此解答该题.
在常温下能与水反应生成氧化物的反应为NO2与水的反应,生成NO和HNO3,则A为NO2,B为HNO3,E为NO,X能与硝酸发生连续的反应,应为变价金属,应为Fe,则C为Fe(NO3)3,D为Fe(NO3)2,
以葡萄糖为燃料的微生物燃料电池,负极发生葡萄糖的氧化反应,生成二氧化碳气体,以此解答该题.
解答:解:由元素在周期表中的位置可知①为H元素,②为Na元素,③为Al元素,④为C元素,⑤为N元素,⑥为O元素,⑦为Cl元素,⑧为S元素,⑨为Fe元素,
(1)Fe在元素周期表中位于第四周期第VIII族,故答案为:四;VIII;
(2)元素①、⑥形成的既含极性键又含非极键的化合物为H2O2,结构式为H-O-O-H,由⑦、⑧元素形成的四原子分子,其各元素原子的最外层电子数满足8电子稳定结构,应生成S2Cl2,电子式为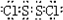 ,故答案为:H-O-O-H;
,故答案为:H-O-O-H;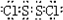 ;
;
(3)在常温下能与水反应生成氧化物的反应为NO2与水的反应,生成NO和HNO3,则A为NO2,B为HNO3,E为NO,X能与硝酸发生连续的反应,应为变价金属,应为Fe,则C为Fe(NO3)3,D为Fe(NO3)2,
NO2与水反应的离子方程式为3NO2+H2O=2H++2NO3-+NO,由B生成C的化学方程式为Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,
C生成D的反应为2Fe(NO3)3+Fe=3Fe(NO3)2,
当生成Fe(NO3)2的物质的量为0.3mol时,需要0.2molFe(NO3)3,由方程式可知需要0.8molHNO3,由3NO2+H2O=2H++2NO3-+NO可知,需要1.2molNO2,
故答案为:3NO2+H2O=2H++2NO3-+NO;Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;1.2;
(4)以葡萄糖为燃料的微生物燃料电池,负极发生葡萄糖的氧化反应,生成二氧化碳气体,电极方程式为C6H12O6+6H2O-24e-=6CO2+24H+,
故答案为:C6H12O6+6H2O-24e-=6CO2+24H+.
(1)Fe在元素周期表中位于第四周期第VIII族,故答案为:四;VIII;
(2)元素①、⑥形成的既含极性键又含非极键的化合物为H2O2,结构式为H-O-O-H,由⑦、⑧元素形成的四原子分子,其各元素原子的最外层电子数满足8电子稳定结构,应生成S2Cl2,电子式为
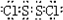 ,故答案为:H-O-O-H;
,故答案为:H-O-O-H;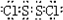 ;
;(3)在常温下能与水反应生成氧化物的反应为NO2与水的反应,生成NO和HNO3,则A为NO2,B为HNO3,E为NO,X能与硝酸发生连续的反应,应为变价金属,应为Fe,则C为Fe(NO3)3,D为Fe(NO3)2,
NO2与水反应的离子方程式为3NO2+H2O=2H++2NO3-+NO,由B生成C的化学方程式为Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,
C生成D的反应为2Fe(NO3)3+Fe=3Fe(NO3)2,
当生成Fe(NO3)2的物质的量为0.3mol时,需要0.2molFe(NO3)3,由方程式可知需要0.8molHNO3,由3NO2+H2O=2H++2NO3-+NO可知,需要1.2molNO2,
故答案为:3NO2+H2O=2H++2NO3-+NO;Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;1.2;
(4)以葡萄糖为燃料的微生物燃料电池,负极发生葡萄糖的氧化反应,生成二氧化碳气体,电极方程式为C6H12O6+6H2O-24e-=6CO2+24H+,
故答案为:C6H12O6+6H2O-24e-=6CO2+24H+.
点评:本题综合考查元素周期表、周期律以及元素化合物知识,侧重于学生的分析能力、推断能力和元素化合物知识的综合运用的考查,为高考常见题型和高频考点,注意把握相关物质的性质以及原电池的工作原理,难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
 (2012?唐山三模)咖啡酸可用作化学原料和中间体,其结构如图.下列关于咖啡酸的说法中不正确的是( )
(2012?唐山三模)咖啡酸可用作化学原料和中间体,其结构如图.下列关于咖啡酸的说法中不正确的是( )