��Ŀ����
��ͭ�к���������п������������Ƚ����������������ʣ������Ӧ������ʵ����������������ͭ��ҺΪ���Һ���õ��ķ����Դ�ͭ�ᴿ������������͵��Һ�н������л��պͺ����ⶨ���ش��������⣺
����һ����⾫�ƣ��������У�����ͭ��Ũ�Ȼ�______��ѡ�����䡢��С����
������������ɺԵ��Һ���д�����
��1����������ۺ����ã�
ϡ���ᴦ��������õ�������ϡ��Һ����д���ò���Ӧ�����ӷ���ʽ��______��
�������м������Ļƽ���λ��ս����Dz������й����ϣ��˽��һЩ�йؽ��֪ʶ�����������ǻ�ȡ��һЩ��Ϣ��
| ��� | ��Ӧ | ƽ�ⳣ�� |
| 1 | Au+6HNO3��Ũ��=Au��NO3��3+3NO2��+3H2O | ����1 |
| 2 | Au3++4Cl-=AuCl4- | ����1 |
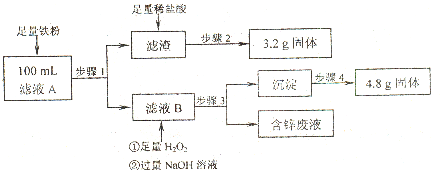
��2����Һ�����IJⶨ�������Ǹ�С��̽����Һ��һ��ʵ�����̣�

��100mL��Һ��Cu2+ ��Ũ��Ϊ______mol?L-1��Fe2+��Ũ��Ϊ______mol?L-1��
���������1�����������Ժ�ϡ���ᷴӦ������������һ��������ˮ�����ݻ�ѧƽ���ƶ�ԭ�����������ܹ�������ˮ��ԭ��
��2�����ݻ�ѧ��Ӧԭ��������ش�
����⣺����һ���ڵ�⾫��ͭʱ��������Ӧ�ǽ���п������������ʧ���ӣ�����ʱ��������ͭ�����Ѿ��õ��ӣ���ͭ�����Ѿ���С�˶���δ�������ϲ���ͭ���ӣ��ʴ�Ϊ����С��
���������1�����������Ժ�ϡ���ᷴӦ������������һ��������ˮ����3Ag+4H++NO3-=3Ag++NO��+2H2O�����ݱ��е���Ϣ��Au+6HNO3��Ũ��=Au��NO3��3+3NO2��+3H2O������Au3++4Cl-=AuCl4-������ˮ�У�����Ũ�����Ũ���ᣬŨ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���AuCl4-���ӣ�ʹ��Ӧ2ƽ�������ƶ������������ˮ�У�
�ʴ�Ϊ��3Ag+4H++NO3-=3Ag++NO��+2H2O��Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���AuCl4-���ӣ�ʹ��Ӧ2ƽ�������ƶ������������ˮ�У�
��2��100mL����Һ�к����������ӡ�ͭ���ӡ�п���ӣ������������Ľ���Fe�ԺὫ����ͭȫ���û��������������ɵ�3.2g������Cu������ͭ���ӵ�Ũ��c=
 =
= =0.5 mol/L���������Ӻ��������Ʒ�Ӧ�����������������ڿ����и��ױ�����Ϊ�������������ȷֽ����ɵ���������������4.8g������ԭ���غ㣬�������ӵ����ʵ����ǣ�
=0.5 mol/L���������Ӻ��������Ʒ�Ӧ�����������������ڿ����и��ױ�����Ϊ�������������ȷֽ����ɵ���������������4.8g������ԭ���غ㣬�������ӵ����ʵ����ǣ� ×2
×2=0.06mol�������������ӵ�Ũ��c=
 =
= =0.6mol/L���ʴ�Ϊ��0.5��0.6��
=0.6mol/L���ʴ�Ϊ��0.5��0.6�������������漰�йص�⾫��ͭ����ѧƽ���ƶ�ԭ���Լ����ʵĺ����IJⶨ���ۺ�֪ʶ������Ƕȹ㣬�ѶȽϴ�

��8�֣�[��ѧ����ѧ�뼼��]
��ͭ�к���������п������������Ƚ����������������ʣ������Ӧ������ʵ����������������ͭ��ҺΪ���Һ���õ��ķ����Դ�ͭ�ᴿ������������͵��Һ�н������л��պͺ����ⶨ���ش��������⣻
��1������һ����⾫�ƣ��������У�����ͭ��Ũ�Ȼ� ��ѡ�����䡢��С����
������������ɺԵ��Һ���д�����
��2����������ۺ����ã�
ϡ���ᴦ��������õ�������ϡ��Һ����д���ò���Ӧ�����ӷ���ʽ�� ��
�������м������Ļƽ���λ��ս����Dz������й����ϣ��˽��һЩ�йؽ��֪ʶ�����������ǻ�ȡ��һЩ��Ϣ��
|
��� |
��Ӧ |
ƽ�ⳣ�� |
|
1 |
Au + 6HNO3��Ũ��= Au(NO3)3 + 3NO2��+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl�� = AuCl4�� |
>>1 |
���п�֪������������ᷴӦ����ȴ��������ˮ��Ũ���������ᰴ�����l��3�Ļ����������Ҫ���ͽ��ܹ�������ˮ��ԭ�� ��
��3�����Һ�����IJⶨ����ͼ�Ǹ�С��̽�����Һ��һ��ʵ�����̣�

��100mL��Һ��Cu2+ ��Ũ��Ϊ mol��L��1 ��Fe2+��Ũ��Ϊ mol��L��1