题目内容
下表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素④的原子结构示意图是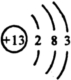
 .
.
(2)元素③与⑥形成的化合物中的化学键类型为
 .
.
(3)在相同条件下,元素②、③、④的单质分别与盐酸反应最缓慢的是(填写化学式)
(4)元素⑤、⑥、⑦的单质氧化性依次(填写“增强”或“减弱”)
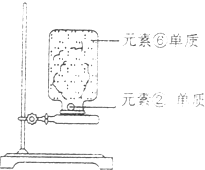
(5)将一小块元素②的单质放在石棉网上,用酒精灯微热,待其熔成球状时,将盛有元素⑥单质的集气瓶迅速倒扣在它的上方(如图所示).写出该反应的化学方程式

请按要求回答下列问题.
(1)元素④的原子结构示意图是


(2)元素③与⑥形成的化合物中的化学键类型为
离子键
离子键
.元素①与⑤形成的化合物的电子式为

(3)在相同条件下,元素②、③、④的单质分别与盐酸反应最缓慢的是(填写化学式)
Al
Al
;这三种元素最高价氧化物对应水化物中碱性最强的是(填写化学式)NaOH
NaOH
;(4)元素⑤、⑥、⑦的单质氧化性依次(填写“增强”或“减弱”)
减弱
减弱
,它们的气态氢化物中稳定性最弱的是(化学式)HBr
HBr
.(5)将一小块元素②的单质放在石棉网上,用酒精灯微热,待其熔成球状时,将盛有元素⑥单质的集气瓶迅速倒扣在它的上方(如图所示).写出该反应的化学方程式
2Na+Cl2
2NaCl
| ||
2Na+Cl2
2NaCl
.
| ||

分析:根据元素所在周期表中的位置可知:①为H元素,②为Na元素,③为Mg元素,④为Al元素,⑤为F元素,⑥为Cl元素,⑦为Br元素,
(1)根据原子核外电子排布特点书写原子结构示意图;
(2)根据组成元素金属性、非金属性的强弱判断化学键的类型;
(3)根据金属性的强弱比较金属单质以及对应化合物的性质;
(4)根据非金属性的强弱比较非金属单质、化合物的性质;
(5)活泼金属与活泼非金属性单质发生化合反应.
(1)根据原子核外电子排布特点书写原子结构示意图;
(2)根据组成元素金属性、非金属性的强弱判断化学键的类型;
(3)根据金属性的强弱比较金属单质以及对应化合物的性质;
(4)根据非金属性的强弱比较非金属单质、化合物的性质;
(5)活泼金属与活泼非金属性单质发生化合反应.
解答:解:(1)④为Al元素,原子序数为13,原子核外有3个电子层,最外层电子数位3,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)元素③与⑥形成的化合物为MgCl2,为离子化合物,含有离子键,元素①与⑤形成的化合物为HF,为共价化合物,电子式为 ,故答案为:离子键;
,故答案为:离子键; ;
;
(3)同周期元素从左到右金属性逐渐减弱,对应金属单质的活泼性逐渐减弱,则与盐酸反应最缓慢的是Al,元素的金属性越强,对应的最高价氧化物对应水化物中碱性越强,Na的金属性最强,则NaOH的碱性最强,故答案为:Al;NaOH;
(4)元素⑤、⑥、⑦处于同一主族,从上到下元素的非金属性逐渐减弱,非金属性越弱,对应的单质的氧化性越弱,氢化物的稳定性越弱,三种元素中Br的非金属性最弱,则HBr的稳定性最弱,故答案为:减弱;HBr;
(5)Na性质活泼,易于Cl2反应生成NaCl,反应的化学方程式为2Na+Cl2
2NaCl,故答案为:2Na+Cl2
2NaCl.
 ,故答案为:
,故答案为: ;
;(2)元素③与⑥形成的化合物为MgCl2,为离子化合物,含有离子键,元素①与⑤形成的化合物为HF,为共价化合物,电子式为
 ,故答案为:离子键;
,故答案为:离子键; ;
;(3)同周期元素从左到右金属性逐渐减弱,对应金属单质的活泼性逐渐减弱,则与盐酸反应最缓慢的是Al,元素的金属性越强,对应的最高价氧化物对应水化物中碱性越强,Na的金属性最强,则NaOH的碱性最强,故答案为:Al;NaOH;
(4)元素⑤、⑥、⑦处于同一主族,从上到下元素的非金属性逐渐减弱,非金属性越弱,对应的单质的氧化性越弱,氢化物的稳定性越弱,三种元素中Br的非金属性最弱,则HBr的稳定性最弱,故答案为:减弱;HBr;
(5)Na性质活泼,易于Cl2反应生成NaCl,反应的化学方程式为2Na+Cl2
| ||
| ||
点评:本题考查位置结构性质的关系及应用,题目难度中等,本题侧重于周期表的运用,注意元素周期律的递变规律,把握物质的性质,注重基础知识的积累.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑧七种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | ⑧ | |
| 3 | ① | ③ | ④ | | | | ⑦ | |
| 4 | ② | | | | | | | |
(1)画出③的原子结构示意图
(2)在①、②、③三种元素的最高价氧化物对应水化物中,碱性最强的是
(填碱的化学式)。
(3)⑦、⑧两元素对应形成的氢化物中,最稳定的是 (填氢化物化学式)。
(4)写出⑤和⑥形成的三原子化合物的化学式
(5)写出①、④元素的最高价氧化物对应水化物之间反应生成的盐的化学式为: 。


