题目内容
下表为元素周期表的一部分,a、b、c…为元素周期表中前4周期的部分元素。
回答下列问题:
(1)d3+的未成对电子数为 个;
(2)请比较e、f、g三种元素的第一电离能由大到小的顺序 (写元素符号)
(3)请写出h元素原子价电子轨道表示式 ;
(4)ea3分子的电子式是 ,其分子的空间构型是 ,分子中e原子的杂化类型是 。
回答下列问题:
| a | | | |||||||||||||||
| | | | | | e | f | g | | |||||||||
| | b | | | | hh | | | | |||||||||
| c | | | | | | | d | [ | d | | | | | | | | |
(2)请比较e、f、g三种元素的第一电离能由大到小的顺序 (写元素符号)
(3)请写出h元素原子价电子轨道表示式 ;
(4)ea3分子的电子式是 ,其分子的空间构型是 ,分子中e原子的杂化类型是 。
(每空2分)(1) 5 (2) F>N>O (3)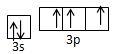
(4)(每空1分)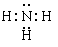 ,三角锥 , sp3
,三角锥 , sp3
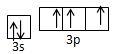
(4)(每空1分)
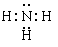 ,三角锥 , sp3
,三角锥 , sp3试题分析:根据元素在周期表中的相对位置可知,a是H,b是Mg,c是K,d是Fe,e是N,f是O,g是F,h是P。
(1)根据铁离子的核外电子排布式可知,d3+的未成对电子数为5个。
(2)非金属越强,第一电离能越大。但由于氮元素的2p轨道电子分别处于半充满状态,稳定性强,第一电离能大于氧元素的,即电负性是F>N>O。
(3)根据构造原理可知,P元素原子价电子轨道表示式为
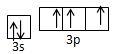 。
。(4)氨气分子中氮原子含有1对孤对电子,所以是三角锥形结构,氮原子是sp3杂化,其电子式是
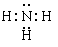 。
。点评:该题是高考中的常见考点,属于基础性试题的考查。试题综合性强,难易适中,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理和抽象思维能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目