题目内容
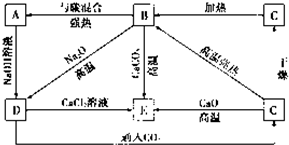 几种含硅元素的物质之间的相互转化关系如图所示.
几种含硅元素的物质之间的相互转化关系如图所示.试判断:
(1)写出下列几种物质的化学式:
A Si B SiO2 C H2SiO3 D
(2)写出下列反应的化学方程式:
①B→A
②B→E
(3)写出下列溶液中反应的离子方程式:
①D→C
②A→D
考点:无机物的推断,硅和二氧化硅
专题:碳族元素
分析:已知A为Si,B为SiO2,C为H2SiO3,结合转化关系可知D为Na2SiO3,E为CaSiO3,结合物质的性质以及题目要求可解答该题.
解答:
解:已知A为Si,B为SiO2,C为H2SiO3,结合转化关系可知D为Na2SiO3,E为CaSiO3,
(1)由以上分析可知D为Na2SiO3,E为CaSiO3,故答案为:Na2SiO3;CaSiO3;
(2)①B为二氧化硅,A为硅,发生反应,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,所以碳是还原剂,二氧化硅是氧化剂,反应方程式为SiO2+2C
Si+2CO↑,
故答案为:SiO2+2C
Si+2CO↑;
②B为二氧化硅,E为硅酸钙,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,反应方程式为SiO2+CaCO3
CaSiO3+CO2↑,
故答案为:SiO2+CaCO3
CaSiO3+CO2↑;
(3)①D为硅酸钠,C为硅酸,D→C发生Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3 离子反应为SiO32-+H2O+CO2=H2SiO3↓+CO32-,
故答案为:SiO32-+H2O+CO2=H2SiO3↓+CO32-;
②A是硅单质,D为硅酸钠,A→D发生Si+2NaOH+H2O═Na2SiO3+2H2↑,离子反应为Si+2OH-+H2O=SiO32-+2H2↑,
故答案为:Si+2OH-+H2O=SiO32-+2H2↑.
(1)由以上分析可知D为Na2SiO3,E为CaSiO3,故答案为:Na2SiO3;CaSiO3;
(2)①B为二氧化硅,A为硅,发生反应,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,所以碳是还原剂,二氧化硅是氧化剂,反应方程式为SiO2+2C
| ||
故答案为:SiO2+2C
| ||
②B为二氧化硅,E为硅酸钙,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,反应方程式为SiO2+CaCO3
| ||
故答案为:SiO2+CaCO3
| ||
(3)①D为硅酸钠,C为硅酸,D→C发生Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3 离子反应为SiO32-+H2O+CO2=H2SiO3↓+CO32-,
故答案为:SiO32-+H2O+CO2=H2SiO3↓+CO32-;
②A是硅单质,D为硅酸钠,A→D发生Si+2NaOH+H2O═Na2SiO3+2H2↑,离子反应为Si+2OH-+H2O=SiO32-+2H2↑,
故答案为:Si+2OH-+H2O=SiO32-+2H2↑.
点评:本题考查无机物的推断,考查综合运用知识的能力,正推法为解答本题的突破口,掌握硅及其化合物之间转化是解答的关键,题目难度中等.

练习册系列答案
相关题目
下列物质不能做还原剂的是( )
| A、H2S |
| B、Fe2+ |
| C、Fe3+ |
| D、SO2 |
某固体混合物可能由Na2CO3、Na2SO4、CuSO4、KCl等混合而成,为检验其组成,依次进行下列实验,且每步所加试剂均过量,观察到的现象如表:
下列分析正确的是( )
| 步骤 | 操作 | 现象 |
| (1) | 将固体混合物溶于水,搅拌 | 溶液无色透明 |
| (2) | 向此溶液中滴加BaCl2溶液 | 出现白色沉淀 |
| (3) | 过滤,将沉淀物置于足量稀硝酸中 | 沉淀完全溶解,有气泡产生 |
| (4) | 向滤液中加入AgNO3和稀硝酸 | 有白色沉淀产生 |
| A、固体混合物中肯定有KCl |
| B、固体混合物中可能含有Na2SO4 |
| C、(2)中发生的离子反应为:Ba2++CO32-=BaCO3;Ba2++SO42-=BaSO4 |
| D、固体混合物中肯定含有Na2CO3 |