题目内容
由铝和某种金属组成的混合物,将它分成质量相等的两份。一份放入过量的盐酸中,混合物全部作用完,放出H2 6.16 L(标准状况),溶液质量比反应前增加4.85 g;另一份放入过量烧碱溶液中,反应完毕后,放出H2 4.48 L(标准状况),溶液的质量比反应前增加3.2 g,而某金属则不反应,沉积出来。求:(1)原混合物中某金属的质量。(2)某金属的相对原子质量。
解析:(1)某金属与盐酸产生的H2为:![]() =0.075 mol。
=0.075 mol。
该金属与盐酸反应使溶液增重为:
4.85 g-3.2 g=1.65 g。
m(金属)=1.65 g+0.075 mol×2 g·mol-1=1.8 g,
原混合物中该金属为3.6 g。
(2)设该金属化合价为+n
则M(金属)=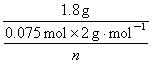 =12n
=12n
讨论 n=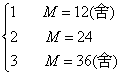
答案:(1)3.6 g (2)24

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目