题目内容
在一恒温、恒容密闭容器中充入1mol CO2和3 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。回答下列问题: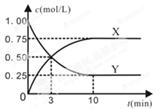
(1)Y的化学式是 。
(2)反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率v(H2)= mol·L-1·min-1。
(3)不能判断该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积比保持不变 | B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) | D.H2转化率为75% |
(5)上述温度下,反应CH3OH (g) + H2O(g)
 CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
(1)CO2 (2)> 0.5 (3)B (4)向右 (5)0.19
解析试题分析:(1)由图像可知生成物X的浓度变化是0.75mol/L,反应物Y的浓度变化也是0.75mol/L。根据反应方程式可知CO2(g)+3H2(g) CH3OH (g)+H2O(g) △H=-49.0 kJ/mol,无论是哪种生成物,方程式的系数都是1,其改变量与反应物相同。则根据反应时各物质的关系可知只能是方程式中的系数为1的物质。因此Y的化学式是CO2。(2)反应进行到10min时得到化学平衡。所以在进行到3min时, v正> v逆,反应正向进行。反应前3min,V(CO2)=0.5mol/L÷3min=1/6mol/(L·min)。由于V(H2) =3V(CO2)=3×1/6mol/(L·min)= 0.5 mol/(L·min)。 (3)A.容器内各气体的体积比保持不变,则任何组分的物质的量不变,物质的量浓度不变,反应达到平衡。正确。B.由于反应是在一恒温、恒容密闭容器中进行。无论反应是否发生,也无论反应进行到哪种程度,由于容器的容积不变、物质的质量不变,所以混合气体密度不变。错误。C.在任何时刻都存在速率关系:3v正(CH3OH) =v正(H2),而3v逆(CH3OH) =v正(H2)。则v正(CH3OH)= v逆(CH3OH)。即用同一物质表示的反应速率V正=V逆。因此反应达到了平衡状态。正确。D.由图像可知:达到平衡状态时c(CO2)=0.25mol/L,改变了0.75mol/L.由于n(CO2):n(H2)=1:3,所以H2改变的浓度3×0.75mol/L,H2的起始浓度3mol/L.所以H2转化率为(3×0.75mol/L ÷3)×100%=75%。正确。因此不能判断该反应达到化学平衡状态的依据的选项是B。(4)上述反应达到平衡后,往容器中同时加入1molCO2和1mol H2O(g),由于增大了反应物的浓度,所以此时平衡将向右移动。(5)上述温度下,反应CH3OH (g) + H2O(g)
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol,无论是哪种生成物,方程式的系数都是1,其改变量与反应物相同。则根据反应时各物质的关系可知只能是方程式中的系数为1的物质。因此Y的化学式是CO2。(2)反应进行到10min时得到化学平衡。所以在进行到3min时, v正> v逆,反应正向进行。反应前3min,V(CO2)=0.5mol/L÷3min=1/6mol/(L·min)。由于V(H2) =3V(CO2)=3×1/6mol/(L·min)= 0.5 mol/(L·min)。 (3)A.容器内各气体的体积比保持不变,则任何组分的物质的量不变,物质的量浓度不变,反应达到平衡。正确。B.由于反应是在一恒温、恒容密闭容器中进行。无论反应是否发生,也无论反应进行到哪种程度,由于容器的容积不变、物质的质量不变,所以混合气体密度不变。错误。C.在任何时刻都存在速率关系:3v正(CH3OH) =v正(H2),而3v逆(CH3OH) =v正(H2)。则v正(CH3OH)= v逆(CH3OH)。即用同一物质表示的反应速率V正=V逆。因此反应达到了平衡状态。正确。D.由图像可知:达到平衡状态时c(CO2)=0.25mol/L,改变了0.75mol/L.由于n(CO2):n(H2)=1:3,所以H2改变的浓度3×0.75mol/L,H2的起始浓度3mol/L.所以H2转化率为(3×0.75mol/L ÷3)×100%=75%。正确。因此不能判断该反应达到化学平衡状态的依据的选项是B。(4)上述反应达到平衡后,往容器中同时加入1molCO2和1mol H2O(g),由于增大了反应物的浓度,所以此时平衡将向右移动。(5)上述温度下,反应CH3OH (g) + H2O(g) CO2(g) + 3H2(g)的平衡常数
CO2(g) + 3H2(g)的平衡常数 .解得K=0.19。
.解得K=0.19。
考点:考查反应时各物质浓度的关系、反应方向和化学平衡状态的判断、化学反应速率与化学平衡常数的计算的知识。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)??2CO2(g)+N2(g) ΔH<0。
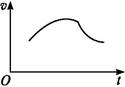
已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验 编号 | T(℃) | NO初始浓度 (mol·L-1) | CO初始浓度 (mol·L-1) | 催化剂的比表 面积(m2·g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | | 1.2×10-3 | | 124 |
| Ⅲ | 350 | | | 82 |
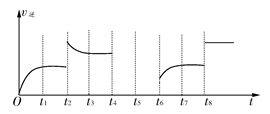
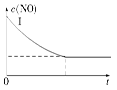
(2)实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如图所示。请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。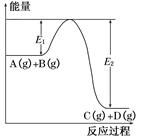
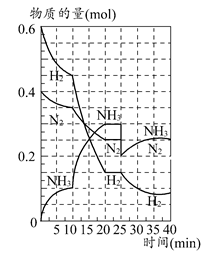
 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。