题目内容
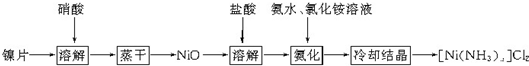
镍配合物在传感器、磁记录材料、储氢材料等方面有着广泛的应用。以镍片为原料制备一种镍配合物
[Ni(NH3)x]Cl2的主要流程如下
[Ni(NH3)x]Cl2的主要流程如下
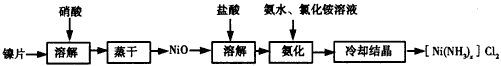
(1)已知镍片与浓、稀硝酸都能反应,该流程中若选用浓硝酸,其优点是_____________,若选用稀硝酸,其优点是____________。
(2)氨化过程中控制溶液pH=9,可防止产品中混有Ni(OH)2沉淀,此时,溶液中c(Ni2+)≤____。
{已知Ksp[Ni(OH)2]=5.0×10-16}
(3)准确称取0.232 g[Ni(NH3)x]Cl2样品,溶于水后加入2.00 mL 6 mol/LHCl,用0.25 mol/LNaOH溶液滴定 过量的盐酸,消耗NaOH溶液24.00 mL。通过计算确定x的值。已知:[Ni(NH3)x]Cl2+HCl→NiCl2+NH4Cl (未配平)(写出解题过程)。
(4)若在[Ni(NH3)x]Cl2样品中存在Ni(OH)2杂质,则上述实验测定的x值____(填“偏大”、“偏小”或“不变”)。
(2)氨化过程中控制溶液pH=9,可防止产品中混有Ni(OH)2沉淀,此时,溶液中c(Ni2+)≤____。
{已知Ksp[Ni(OH)2]=5.0×10-16}
(3)准确称取0.232 g[Ni(NH3)x]Cl2样品,溶于水后加入2.00 mL 6 mol/LHCl,用0.25 mol/LNaOH溶液滴定 过量的盐酸,消耗NaOH溶液24.00 mL。通过计算确定x的值。已知:[Ni(NH3)x]Cl2+HCl→NiCl2+NH4Cl (未配平)(写出解题过程)。
(4)若在[Ni(NH3)x]Cl2样品中存在Ni(OH)2杂质,则上述实验测定的x值____(填“偏大”、“偏小”或“不变”)。
(1)反应快,易蒸干;溶解单位质量的镍所消耗硝酸的质量少
(2)5.0×10-6mol/L
(3)解法一:n(NH3)=(2.00×6×10-3-0. 25×24. 00×10-3) mol=6×10-3mol
(2)5.0×10-6mol/L
(3)解法一:n(NH3)=(2.00×6×10-3-0. 25×24. 00×10-3) mol=6×10-3mol
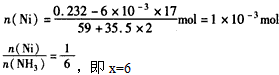
解法二:根据题目提供的化学方程式可知,NH3+HCl=NH4Cl,NaOH+HCl=NaCl+H2O,其中与NH3反应的HCl的物质的量=6mol/L×0.002L-0. 25mal/L×0.024L=0. 006mol,则
n(NH3) =0. 006 mol,故,解得x=6。
(4)偏小
n(NH3) =0. 006 mol,故,解得x=6。
(4)偏小

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目