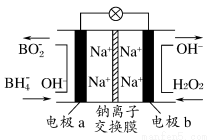
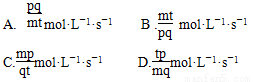题目内容
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液。回答下列问题:
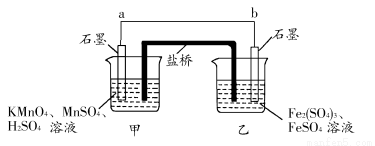
(1)发生氧化反应的烧杯是________(填“甲”或“乙”)。
(2)外电路的电流方向为:从________到________。(填“a”或“b”)
(3)电池工作时,盐桥中的SO42—移向________(填“甲”或“乙”)烧杯。
(4)甲烧杯中发生的电极反应为______________________________。
(1)乙 (2)a b (3)乙
(4)MnO4—+8H++5e-=Mn2++4H2O
【解析】根据氧化还原反应可知:甲烧杯中石墨作正极,发生还原反应,电极反应为:MnO4—+8H++5e-=Mn2++4H2O;乙烧杯中石墨作负极,发生氧化反应,电极反应为Fe2+-e-=Fe3+,外电路电流方向从正极流向负极,即从a到b。电池工作时,盐桥中的阴离子移向负极,阳离子移向正极,即SO42—移向乙烧杯。

练习册系列答案
相关题目