题目内容
【题目】二氧化硫的含量是空气质量监测的一个重要指标。
I.二氧化硫被雨水吸收后就形成了酸雨,某兴趣小组同学汲取热电厂附近的雨水进行实验。
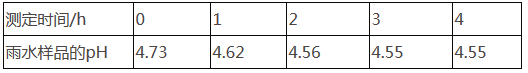
① 测得该雨水样品的pH为4.73;
② 每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为___________________。
(2)分析上述数据变化,你认为形成这一变化的原因是__________________。
II.兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Cl2+H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。
(1)过滤时,除去沉淀中附着的过量氧化钡的方法是_____________。
(2)计算该空气样品中二氧化硫的体积分数(写出计算过程)________
【答案】 大气中的CO2溶于雨水 H2SO3与空气中的O2作用转化为H2SO4,使雨水的酸性增强,pH减小 在漏斗中用蒸馏水淋洗 根据SO2~H2SO4~BaSO4,可得n(SO2)=0.00100mol,该1.000L空气中含有SO2的体积为0.0224L,该同学样品中SO2的体积分数为2.24%(4分)
【解析】试题分析:I.(1)雨水中溶有酸性气体二氧化碳;(2)亚硫酸能被氧气氧化为强酸硫酸;II.所得溶液中加入过量的氯化钡溶液,产生白色沉淀是硫酸钡,根据关系式SO2![]() H2SO4
H2SO4![]() BaSO4计算SO2的体积;
BaSO4计算SO2的体积;
解析:I.(1)大气中的CO2溶于雨水,使正常雨水的PH为5.6。(2)酸雨含有弱酸亚硫酸,亚硫酸能被氧气氧化为强酸硫酸,雨水酸性增强,PH减小;II.(1)过滤时,除去沉淀中附着的过量氧化钡的方法是在过滤器中加入蒸馏水,蒸馏水没过固体,让蒸馏水自然流下,重复2![]() 3次;(2)产生白色沉淀是硫酸钡,硫酸钡的物质的量是0.233g÷233 g/mol = 0.001 mol ,根据SO2
3次;(2)产生白色沉淀是硫酸钡,硫酸钡的物质的量是0.233g÷233 g/mol = 0.001 mol ,根据SO2![]() H2SO4
H2SO4![]() BaSO4,可得n(SO2)=0.00100mol,该1.000L空气中含有SO2的体积为0.00100mol ×22.4 L/mol = 0.0224L,该同学样品中SO2的体积分数为0.0224L ÷1L×100%=2.24%。
BaSO4,可得n(SO2)=0.00100mol,该1.000L空气中含有SO2的体积为0.00100mol ×22.4 L/mol = 0.0224L,该同学样品中SO2的体积分数为0.0224L ÷1L×100%=2.24%。