题目内容
现有A.B.C.D四种元素,前三种元素的离子结构都和氖原子具有相同的核外电子排布。A没有正价态的化合物;B的氢化物化学式为![]() ,0.2mol的C原子能从酸中置换产生2.24L
,0.2mol的C原子能从酸中置换产生2.24L ![]() (S.T.P.)。 D的原子核中没有中子。
(S.T.P.)。 D的原子核中没有中子。
(1)根据以上条件,计算、推断A.B.C.D的元素名称。
(2)用电子式表示C与A, B与D,C与B(加热条件下),相互结合成的化合物,指出其化学键类型及化合物的类型。
(1)A为氟、B为氧、C为钠、D为氢。
(2)C与A的化合物为![]() ,通过离子键结合而成,是离子晶体。
,通过离子键结合而成,是离子晶体。
![]()
B与D的化合物为![]() ,是通过共价键形成的分子,通过分子间作力结合而成晶体,是分子晶体。
,是通过共价键形成的分子,通过分子间作力结合而成晶体,是分子晶体。
![]()
C与B在加热条件下生成的化合物为 Na2O2,既含有离子键又含有共价键,是离子晶体。
![]()

 阅读快车系列答案
阅读快车系列答案(10分)现有A、B、C、D四种短周期元素(零族除外),请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质或结构信息 |
元素非金属性较强,其最高价氧化物对应的水化物为强酸,但其单质稳定,常作保护气。 |
原子核外电子占了4个轨道 |
原子半径仅比氢原子大,其氢化物溶于水形成弱酸 |
原子核外有5种不同能量的电子,且s电子数比p电子数少1个 |
(1)A元素原子的核外电子排布式为: 。
(2)写出C元素的单质与水反应的化学方程式 ;A、C两元素的氢化物的稳定性强弱是 > (用化学式表示)。
(3)D元素最高价氧化物对应的水化物呈 (选填“酸性”、“碱性”或“两性”)。
(4)B元素最简单的氢化物分子为 分子(选填“极性”或“非极性”)。4g该氢化物在空气中完全燃烧生成液态水时,放出222.575kJ热量,写出表示该氢化物燃烧热的热化学方程式 。
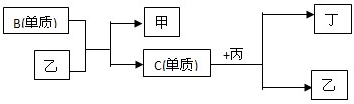 现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙3分子中含相同数目的质子数,C、D结合生成化合物丁.有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙3分子中含相同数目的质子数,C、D结合生成化合物丁.有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图: