题目内容
 下列叙述不正确的是( )
下列叙述不正确的是( )分析:A、电解池工作时,阳极上溶液中阴离子失电子发生氧化反应.
B、锌、铁和海水能构成原电池,较活泼的金属作负极,较不活泼的金属作正极.
C、钢铁的吸氧腐蚀中,正极上得电子发生还原反应.
D、构成原电池的条件之一是能自发的进行氧化还原反应.
B、锌、铁和海水能构成原电池,较活泼的金属作负极,较不活泼的金属作正极.
C、钢铁的吸氧腐蚀中,正极上得电子发生还原反应.
D、构成原电池的条件之一是能自发的进行氧化还原反应.
解答:解:A、工业上电解饱和食盐水时,溶液中氯离子的放电能力大于氢氧根离子的放电能力,所以阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑,故正确.
B、锌、铁和海水能构成原电池,锌作负极,铁作正极,负极上失电子反应氧化反应,从而锌保护了铁被腐蚀,故正确.
C、钢铁的吸氧腐蚀时,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故正确.
D、该装置中银不能和盐酸自发的进行氧化还原反应,所以不能构成原电池,故错误.
故选D.
B、锌、铁和海水能构成原电池,锌作负极,铁作正极,负极上失电子反应氧化反应,从而锌保护了铁被腐蚀,故正确.
C、钢铁的吸氧腐蚀时,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故正确.
D、该装置中银不能和盐酸自发的进行氧化还原反应,所以不能构成原电池,故错误.
故选D.
点评:本题考查了原电池原理和电解池原理,难度不大,明确原电池的构成条件是解D选项的关键.

练习册系列答案
相关题目
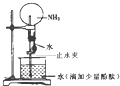 如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )
如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )| A、该实验说明氨气是一种极易溶于水的气体 | B、进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性 | C、氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化 | D、形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都能燃烧,生成二氧化碳和水 | B、都容易发生加成反应 | C、乙烯易发生加成反应,苯只能在特殊条件下才发生加成反应 | D、乙烯易被酸性高锰酸钾溶液氧化,苯不能被酸性高锰酸钾溶液氧化 |