题目内容
(1)BrCl3性质与卤素单质相似,具有很强氧化性。将BrCl3溶于水,再通入SO2,写出该反应的化学方程式________。(2)若将4.66 g BrCln溶于水,再通入过量SO2,反应后,将反应调节至中性,并加入过量Ba(NO3)2,除去沉淀后,所得溶液再用过量AgNO3溶液处理,得到15.46g沉淀,试确定BrCln中的n值。
答案:
解析:
解析:
| 【解法一】(关系式法):(1)已知Cl2+SO2+2H2O=2HCl+H2SO4,又知BrCl3与卤素单质性质相似,也应发生上述类似反应,不同的是BrCl3中Br为+3价,Cl为-1价,
故反应方程式为:BrCl3+2SO2+4H2O=HBr+3HCl+2H2SO4 (2)有关方程式为:
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3,H++OH-=H2O,Cl-+Ag+=AlCl↓ Br-+Ag+=AgBr↓得关系式BrCln~AgBr↓~nAgCl↓,
得n=3 【解法二】 (守恒法) AgBr、AgCl共15.46 g, 则4.66 gBrCln可结合Ag+为:
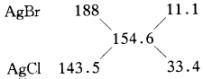
有 n=3 【解法三】 (十字相乘法)
AgBr、AgCl混合物的
n=3
|

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目