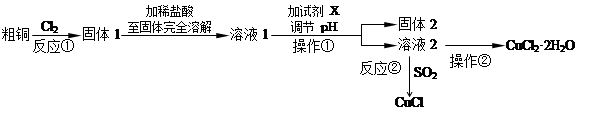题目内容
将钠、铝混合物(质量A1g)投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体7.84L.向溶液中逐滴加入浓度为2mol?L-1的H2SO4溶液,至100ml时白色沉淀达到最大量.继续滴入H2SO4溶液,当加入H2SO4溶液的体积为xml时沉淀恰好消失.将所得溶液蒸干灼烧得固体A2g.下列关系式中不正确的是( )
| A.沉淀达到最大量时溶液中的溶质为Na2SO4、NaHSO4 |
| B.x=75ml |
| C.A1=11.9 |
| D.白色沉淀最大量为7.8g |
A.将钠、铝混合物投入水中,发生的反应为2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,向溶液中加入硫酸,当沉淀量最大时,发生的反应为2H2O+2NaAlO2+H2SO4=2 Al(OH)3↓+Na2SO4,溶液中的溶质是Na2SO4,故A错误;
B.当沉淀的量最大时,溶液中的溶质是硫酸钠,根据Na2SO4中钠离子和硫酸根离子的关系得n(Na)=2n(H2SO4)=0.4mol,根据转移电子相等得n(Al)=
=0.1mol,
根据铝原子守恒得n( Al(OH)3)=0.1mol,根据2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O知,需要硫酸的物质的量为0.15mol,则硫酸体积=
=75mL,
故B正确;
C.通过以上分析知,n(Na)=0.4mol,n(Al)=0.1mol,所以A1=23g/mol×0.4mol+27g/mol×0.1mol=11.9g,故C正确;
D.根据原子守恒知,当沉淀最大时,n( Al(OH)3)=0.1mol,则m( Al(OH)3)=0.1mol×78g/mol=7.8g,故D正确;
故选A.
B.当沉淀的量最大时,溶液中的溶质是硫酸钠,根据Na2SO4中钠离子和硫酸根离子的关系得n(Na)=2n(H2SO4)=0.4mol,根据转移电子相等得n(Al)=
| ||
| 3 |
根据铝原子守恒得n( Al(OH)3)=0.1mol,根据2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O知,需要硫酸的物质的量为0.15mol,则硫酸体积=
| 0.15mol |
| 2mol/L |
故B正确;
C.通过以上分析知,n(Na)=0.4mol,n(Al)=0.1mol,所以A1=23g/mol×0.4mol+27g/mol×0.1mol=11.9g,故C正确;
D.根据原子守恒知,当沉淀最大时,n( Al(OH)3)=0.1mol,则m( Al(OH)3)=0.1mol×78g/mol=7.8g,故D正确;
故选A.

练习册系列答案
相关题目