题目内容
【题目】某磷肥厂利用某磷矿石[Ca3 (PO4) 2]制取磷肥[Ca (H2PO4 )2] 并综合利用副产物生产水泥的工艺流程如图:

(1)将磷矿石制成磷肥的目的是________,有关的化学方程式为__________.
(2)在该工艺流程中高硫煤粉不需要脱硫,理由是____________.
(3)工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2mol SO2、1mol O2充入体积为2L的密闭容器中充分反应,此时测得SO2的物质的量为1mol.则平衡常数K为______________
(4)工业上用接触法制硫酸,最后的产品是98%的硫酸或组成为2H2SO4·SO3的发烟硫酸(H2SO4和H2SO4·SO3的混合物,其中SO3的质量分数约为29%)。98%的浓硫酸可表示为SO3·aH2O,含SO329%的发烟硫酸可表示为bSO3·H2O,用m(H2O)=kn(SO3)分别表示SO3转化成上述两种硫酸时,用水的质量与SO3物质的量的关系式分别是
m1(H2O)=____________ n1(SO3)
m2(H2O)=_________ n2(SO3)
【答案】 将难溶于水的Ca3(PO4)2转化为易溶于水的Ca(H2PO4)2,便于植物吸收 Ca3(PO4)2+2H2SO4=2CaSO4+Ca(H2PO4)2 S与O2反应产生的SO2可用于生产H2SO4而循环使用 4 20 12
【解析】本题主要考查对于“某磷肥厂利用某磷矿石制取磷肥并综合利用副产物生产水泥的工艺流程”的评价。
(1)将磷矿石制成磷肥的目的是将难溶于水的Ca3(PO4)2转化为易溶于水的Ca(H2PO4)2,便于植物吸收,有关的化学方程式为Ca3(PO4)2+2H2SO4=2CaSO4+Ca(H2PO4)2。
(2)在该工艺流程中高硫煤粉不需要脱硫,理由是S与O2反应产生的SO2可用于生产H2SO4而循环使用。
(3)平衡浓度:c(SO2)=0.5mol/L,c(O2)=0.25mol/L,c(SO2)=0.5mol/L,K=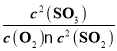 =4.
=4.
(4)98%的浓硫酸可表示为SO3·10/9H2O,含SO329%的发烟硫酸可表示为1.5SO3·H2O,m1(H2O)=k1n1(SO3),m2(H2O)=k2n2(SO3),k1=20,k2=12.




