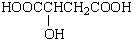题目内容
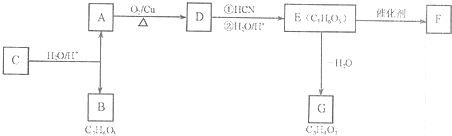
有机物A是常见的有机物,现有如下反应关系
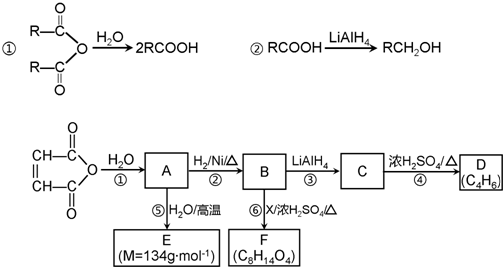
已知:①醛可以发生如下反应:
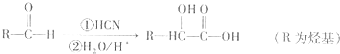
②B与乙酸酐(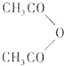 )能发生取代反应生成阿司匹林(
)能发生取代反应生成阿司匹林(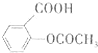 )
)
③F为一种可降解高分子聚合物.
(1)A生成D的化学方程式是 .
(2)B分子中的含氧官能团是 .
(3)G的结构简式是 .
(4)E生成F的化学方程式是 .
(5)H与C互为同分异构体,H分子中苯环上取代基与C相同,H的结构简式可能是 .

已知:①醛可以发生如下反应:
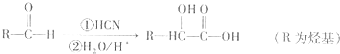
②B与乙酸酐(
 )能发生取代反应生成阿司匹林(
)能发生取代反应生成阿司匹林( )
)③F为一种可降解高分子聚合物.
(1)A生成D的化学方程式是
(2)B分子中的含氧官能团是
(3)G的结构简式是
(4)E生成F的化学方程式是
(5)H与C互为同分异构体,H分子中苯环上取代基与C相同,H的结构简式可能是
分析:A能发生氧化反应生成D,A属于醇,D发生信息①的反应得到E,由E的分子式C3H6O3可知,A、D中含有2个C原子,故D为CH3CHO、A为CH3CH2OH,则E为CH3CH(OH)COOH,E脱掉1分子水生成G,则G为CH2=CHCOOH,E发生缩聚反应生成高分子化合物F,则F为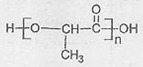 .B与乙酸酐(
.B与乙酸酐( )能发生取代反应生成阿司匹林(
)能发生取代反应生成阿司匹林( ),则B为
),则B为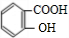 ,C酸性条件下水解得到B、A,则C为
,C酸性条件下水解得到B、A,则C为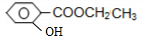 ,据此解答.
,据此解答.
 .B与乙酸酐(
.B与乙酸酐( )能发生取代反应生成阿司匹林(
)能发生取代反应生成阿司匹林( ),则B为
),则B为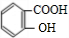 ,C酸性条件下水解得到B、A,则C为
,C酸性条件下水解得到B、A,则C为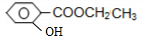 ,据此解答.
,据此解答.解答:解:A能发生氧化反应生成D,A属于醇,D发生信息①的反应得到E,由E的分子式C3H6O3可知,A、D中含有2个C原子,故D为CH3CHO、A为CH3CH2OH,则E为CH3CH(OH)COOH,E脱掉1分子水生成G,则G为CH2=CHCOOH,E发生缩聚反应生成高分子化合物F,则F为 .B与乙酸酐(
.B与乙酸酐( )能发生取代反应生成阿司匹林(
)能发生取代反应生成阿司匹林( ),则B为
),则B为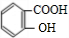 ,C酸性条件下水解得到B、A,则C为
,C酸性条件下水解得到B、A,则C为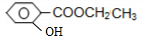 ,
,
(1)A生成D的化学方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;
(2)B为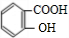 ,分子中的含氧官能团是羧基、羟基,故答案为:羧基、羟基;
,分子中的含氧官能团是羧基、羟基,故答案为:羧基、羟基;
(3)由上述分析可知,G的结构简式是CH2=CHCOOH,故答案为:CH2=CHCOOH;
(4)E生成F的化学方程式为: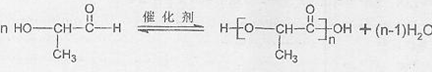 ,
,
故答案为: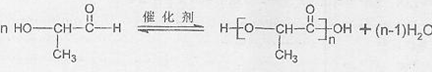 ;
;
(5)H与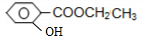 互为同分异构体,H分子中苯环上取代基与C相同,H的结构简式可能是
互为同分异构体,H分子中苯环上取代基与C相同,H的结构简式可能是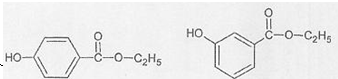 ,故答案为:
,故答案为: .
.
 .B与乙酸酐(
.B与乙酸酐( )能发生取代反应生成阿司匹林(
)能发生取代反应生成阿司匹林( ),则B为
),则B为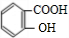 ,C酸性条件下水解得到B、A,则C为
,C酸性条件下水解得到B、A,则C为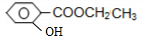 ,
,(1)A生成D的化学方程式为:2CH3CH2OH+O2
| Cu |
| △ |
| Cu |
| △ |
(2)B为
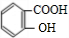 ,分子中的含氧官能团是羧基、羟基,故答案为:羧基、羟基;
,分子中的含氧官能团是羧基、羟基,故答案为:羧基、羟基;(3)由上述分析可知,G的结构简式是CH2=CHCOOH,故答案为:CH2=CHCOOH;
(4)E生成F的化学方程式为:
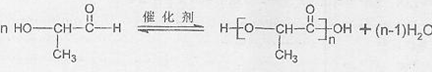 ,
,故答案为:
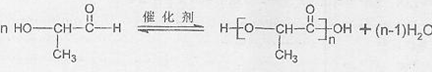 ;
;(5)H与
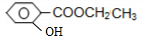 互为同分异构体,H分子中苯环上取代基与C相同,H的结构简式可能是
互为同分异构体,H分子中苯环上取代基与C相同,H的结构简式可能是 ,故答案为:
,故答案为: .
.点评:本题考查有机物的推断与合成,需要学生对给予的信息进行利用,根据E的分子式结合反应信息进行推断,能较好的考查考生的阅读、自学能力和思维能力,是热点题型.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目