题目内容
12.将氢气、氧气、二氧化碳4:1:1的体积混合,点燃爆炸后,再与红热足量的炭充分反应,当恢复到原温度时,混合气体压强是原气体压强的( )| A. | $\frac{3}{4}$ | B. | $\frac{4}{3}$ | C. | $\frac{2}{3}$ | D. | $\frac{1}{3}$ |
分析 点燃发生:2H2(g)+O2(g)═2H2O,通过红热足量的碳,发生反应:H2O+C=H2+CO、CO2+C═2CO,整个过程相当于:2C+O2=2CO、CO2+C═2CO,假设氢气、氧气、二氧化碳的物质的量分别为4mol、1mol、1mol,计算反应后CO的物质的量,可得反应后气体总物质的量,相同条件下气体压强之比等于物质的量之比.
解答 解:假设氢气、氧气、二氧化碳的物质的量分别为4mol、1mol、1mol,则开始时气体总物质的量为6mol,
点燃发生:2H2(g)+O2(g)═2H2O,通过红热足量的碳,发生反应:H2O+C=H2+CO、CO2+C═2CO,整个过程相当于:2C+O2=2CO、CO2+C═2CO,由方程式可知生成CO为2×(1mol+1mol)=4mol,则反应后气体总物质的量为4mol+4mol=8mol,
相同条件下气体压强之比等于物质的量之比,故当恢复到原温度时,混合气体压强是原气体压强的$\frac{8mol}{6mol}$=$\frac{4}{3}$倍,
故选:B.
点评 本题考查化学方程式有关计算、阿伏伽德罗定律及其推理,侧重考查学生分析计算能力.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
2.下列说法正确的是( )
| A. | 晶体中含有金属阳离子,说明该物质一定是离子晶体 | |
| B. | SiO2既能溶于NaOH溶液又能溶于HF,说明SiO2是两性氧化物 | |
| C. | 高分子分离膜可使海水淡化,说明该过程发生了化学变化 | |
| D. | 一束光射入蛋白质溶液中可以看到一条光亮的通路,说明蛋白质溶液属于胶体 |
20.获得“863”计划支持的环境友好型铝碘电池已研制成功,电解质溶液为AlI3溶液,电池总反应式为2Al+3I2═2AlI3.下列说法不正确的是( )
| A. | 该电池负极的电极反应为:Al-3e-=Al3+ | |
| B. | 电池工作时,溶液中铝离子向正极移动 | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 | |
| D. | 当导线中有3.612×1024个电子通过时,电池负极质量减少27g |
4.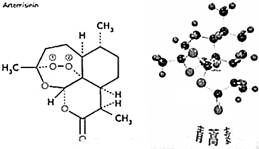 我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
 我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素易溶于水 | ||
| C. | 1mol 青蒿素不能发生还原反应 | D. | 青蒿素中碳原子共有三种杂化方式 |
2.利用下列反应不能制得较为纯净的括号中的物质的是( )
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 乙炔先加一分子HCl,再加H2(氯乙烷) | |
| C. | Cl2和苯用FeCl3作催化剂(氯苯) | |
| D. | 等物质的量的Cl2和C2H6在光照条件下(氯乙烷) |

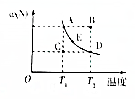 一定条件下,在某密闭恒压容器中发生反应:2M(g)?N(g)△H=a kJ•mol-1,达到平衡时,N的质量分数[ω(N)]与温度的变化关系如图所示:
一定条件下,在某密闭恒压容器中发生反应:2M(g)?N(g)△H=a kJ•mol-1,达到平衡时,N的质量分数[ω(N)]与温度的变化关系如图所示: