题目内容
【题目】将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)2C(g),若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法:
①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7molL﹣1
其中正确的是( )
A.①③
B.①④
C.②③
D.③④
【答案】B
【解析】解:利用三段式法计算:
起始A的浓度为 ![]() =2mol/L,B的浓度为
=2mol/L,B的浓度为 ![]() =1mol/L
=1mol/L
2A(g)+ | B(g) | 2C(g) | ||
起始: | 2mol/L | 1mol/L | 0 | |
变化: | 0.6mol/L | 0.3mol/L | 0.6mol/L | |
2s时 | 1.4mol/L | 0.7mol/L | 0.6mol/L |
2s内,用物质A表示的反应的平均速率为v(A)= ![]() =0.3molL﹣1s﹣1;
=0.3molL﹣1s﹣1;
2s内,用物质B表示的反应的平均速率为v(B)= ![]() =0.15molL﹣1s﹣1;
=0.15molL﹣1s﹣1;
2s时物质A的转化率为α= ![]() ×100%=30%;
×100%=30%;
2s时物质B的浓度为0.7molL﹣1 ,
显然①④正确,
故选:B.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
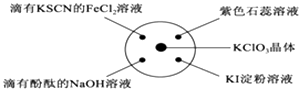
寒假创新型自主学习第三学期寒假衔接系列答案【题目】已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 石蕊试液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝 | Cl2具有氧化性 |
A.A
B.B
C.C
D.D