题目内容
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3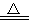 2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为( )
2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为( )
A.5∶4 B.5∶3 C.1∶1 D.3∶5
练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
题目内容
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3 2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为( )
2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为( )
A.5∶4 B.5∶3 C.1∶1 D.3∶5
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案