题目内容
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表:| 元素 | Mn | Fe | |
电离能(kJ/mol) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Mn元素基态原子的价电子排布式为
3d54s2
3d54s2
.比较锰和铁两元素的电离能I2和I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是:
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转化为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6转化为稳定的3d5半充满较稳定状态,需要的能量相对要少
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转化为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6转化为稳定的3d5半充满较稳定状态,需要的能量相对要少
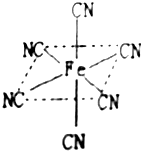
.(2)铁元素广泛应用,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,其配离子结构如图(离子所带电荷未标出).
①铁元素在周期表中的位置是
第四周期Ⅷ族
第四周期Ⅷ族
.②已知CN-与N2结构相似,CN-中C原子的杂化方式是
sp1
sp1
.③写出沉淀溶解的化学方程式
Fe(CN)2+4KCN═K4[Fe(CN)6]
Fe(CN)2+4KCN═K4[Fe(CN)6]
.分析:(1)锰元素的3d能级和4s能级上的电子都是价电子,据此写出Mn元素基态原子的价电子排布式,轨道上的电子处于全满、半满、全空时最稳定;
(2)①铁元素在周期表中的位置是第四周期第VIIIA族;
②根据C原子价层电子对个数确定杂化方式;
③Fe(CN)2沉淀和KCN反应生成络合物.
(2)①铁元素在周期表中的位置是第四周期第VIIIA族;
②根据C原子价层电子对个数确定杂化方式;
③Fe(CN)2沉淀和KCN反应生成络合物.
解答:解:(1)锰元素的3d能级和4s能级上的电子都是价电子,Mn元素基态原子的价电子排布式为3d54s2,由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转化为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6转化为稳定的3d5半充满较稳定状态,需要的能量相对要少,
故答案为:3d54s2,由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转化为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6转化为稳定的3d5半充满较稳定状态,需要的能量相对要少;
(2)①铁元素在周期表中的位置是第四周期Ⅷ族,故答案为:第四周期Ⅷ族;
②CN-中C原子价层电子对个数=1+
(4+1-1×3)=2,所以采取sp1杂化,故答案为:sp1;
③Fe(CN)2沉淀和KCN反应生成络合物,反应方程式为Fe(CN)2+4KCN═K4[Fe(CN)6],故答案为:Fe(CN)2+4KCN═K4[Fe(CN)6].
故答案为:3d54s2,由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转化为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6转化为稳定的3d5半充满较稳定状态,需要的能量相对要少;
(2)①铁元素在周期表中的位置是第四周期Ⅷ族,故答案为:第四周期Ⅷ族;
②CN-中C原子价层电子对个数=1+
| 1 |
| 2 |
③Fe(CN)2沉淀和KCN反应生成络合物,反应方程式为Fe(CN)2+4KCN═K4[Fe(CN)6],故答案为:Fe(CN)2+4KCN═K4[Fe(CN)6].
点评:本题考查了价电子排布式的书写、杂化方式的判断等知识点,难点是价电子的判断、价层电子对个数的计算,注意基础知识的积累.

练习册系列答案
相关题目
 (2009?海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
(2009?海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表: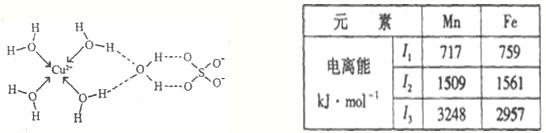
 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛. 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.