题目内容
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 ( )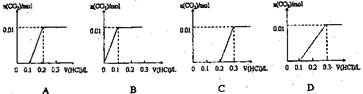
【答案】
C
【解析】
试题分析:首先,加入的稀盐酸先和NaOH溶液反应,没有二氧化碳生产,HCl+NaOH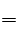 NaCl+H2O,NaOH有0.4g,故需消耗HCl 0.1L,接着,稀盐酸和Na2CO3反应,刚开始,盐酸不足,故发生的反应为Na2CO3+HCl
NaCl+H2O,NaOH有0.4g,故需消耗HCl 0.1L,接着,稀盐酸和Na2CO3反应,刚开始,盐酸不足,故发生的反应为Na2CO3+HCl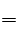 NaHCO3+NaCl,消耗HCl 0.1L,生成0.01molNaHCO3,继续滴加盐酸溶液,发生的反应为NaHCO3+HCl
NaHCO3+NaCl,消耗HCl 0.1L,生成0.01molNaHCO3,继续滴加盐酸溶液,发生的反应为NaHCO3+HCl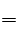 NaCl+H2O+CO2 ,当反应完全时,消耗HCl
0.1L,共生成CO2 0.01mol,综上所述,答案为C。
NaCl+H2O+CO2 ,当反应完全时,消耗HCl
0.1L,共生成CO2 0.01mol,综上所述,答案为C。
考点:Na2CO3的化学性质。
点评:本题需要学生对Na2CO3溶液性质的理解,对于反应物的过量与不足问题,是高考常考的一个知识点,故学生要在平时的学习中,归纳总结出具有此性质的物质。

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目



