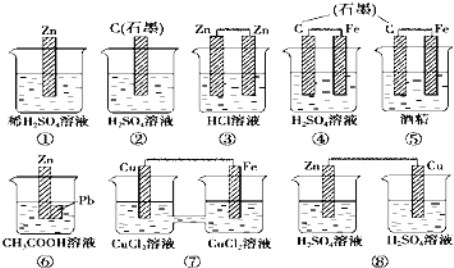
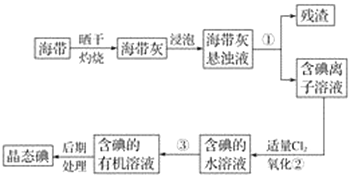
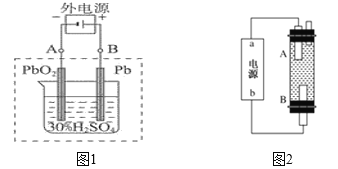
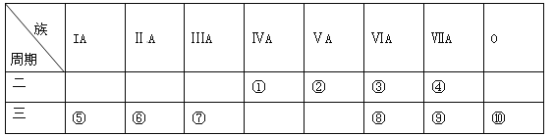
题目内容
【题目】写出符合离子方程式Ba2++SO42- =BaSO4↓的一种化学方程式_________________。
【答案】BaCl2 + H2SO4== BaSO4↓ + 2HCl
【解析】
离子方程式Ba2++SO42- =BaSO4↓说明是可溶性的钡盐或Ba(OH)2与可溶性的硫酸盐反应,或者可溶性的钡盐与硫酸反应,即:BaCl2 + H2SO4=BaSO4↓+ 2HCl,答案:BaCl2 + H2SO4= BaSO4↓+ 2HCl。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】氮及其化合物在生产生活中有重要作用。
(1)已知:①氢气的燃烧热为285 kJ/mol ②N2(g) + 2O2(g) = 2NO2(g) ΔH=+133 kJ/mol。试写出H2还原NO2生成液态水和另一种无毒物质的热化学方程式_________________。
(2)一氯胺(NH2Cl)的电子式为_______________,一氯胺是重要的水消毒剂,其原因是一氯胺在水中会部分水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为______________。
(3)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 20 | 40 | 60 | 80 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应的ΔH______0(填“>”或“<”) ,乙容器中,0~40 min内用Cl2的浓度变化表示的平均反应速率v(Cl2)=_______________________。
②对该反应,下列说法不正确的是________________(填选项字母)。
A.若甲容器内气体密度不变,则表明反应达到平衡状态
B.若乙容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,分离出少量产物NHCl2,有助于提高Cl2的转化率
③恒温条件下,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,则A、B、C三点中Cl2转化率最高的是_________(填“A”“B”或“C”)。