题目内容
在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下反应:
CO(气)+H2O(气) CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的
CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的
CO(气)+H2O(气)
 CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的
CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的 | A.5.75倍 |
| B.11.5倍 |
| C.30.67倍 |
| D.46倍 |
B
平衡混合气体与氢气的密度比就等于分子量比。此题的关

混合气体的总的物质的量。根据质量守衡定律,平衡混合气的质量应等于起始的1molCO和1mol水蒸气之和。根据化学方程式反应前后气体的总的物质的量不变,无论化学平衡怎样移动,平衡混合气的总的物质的
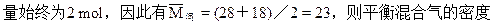
为相同条件下H2密度为11.5倍。

混合气体的总的物质的量。根据质量守衡定律,平衡混合气的质量应等于起始的1molCO和1mol水蒸气之和。根据化学方程式反应前后气体的总的物质的量不变,无论化学平衡怎样移动,平衡混合气的总的物质的
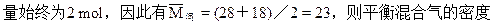
为相同条件下H2密度为11.5倍。

练习册系列答案
相关题目
 2Z
2Z 2H2+O2与2H2+O2
2H2+O2与2H2+O2 2H2O互为可逆反应
2H2O互为可逆反应 CO2(g)+H2(g),K=9,求CO的转化率。
CO2(g)+H2(g),K=9,求CO的转化率。 2HI已达到平衡状态的是
2HI已达到平衡状态的是 B(气)+ 3C(气),若知所得混合气体对氢气的相对密度为4.25,则A的化学式量可能为
B(气)+ 3C(气),若知所得混合气体对氢气的相对密度为4.25,则A的化学式量可能为  2C反应达到化学平衡。
2C反应达到化学平衡。 2NH3 △H<0,进行程度增大的是( )
2NH3 △H<0,进行程度增大的是( )