题目内容
【选修2-化学与技术】(15分)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
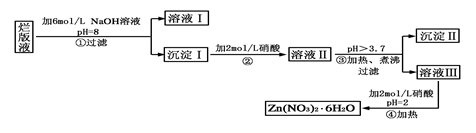
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
(1)Zn(NO3)2 (1分)4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O (2分)
(2)防止生成的Zn (OH)2沉淀被溶解(2分)
(3)Zn(OH)2和Fe(OH)3 (2分)
(4)促使Fe3+完全水解 温度越高,水解程度越大(2分)
(5)抑制Zn2+水解为Zn(OH)2 (2分)
蒸发皿、酒精灯、铁架台、玻璃棒(4分)
(2)防止生成的Zn (OH)2沉淀被溶解(2分)
(3)Zn(OH)2和Fe(OH)3 (2分)
(4)促使Fe3+完全水解 温度越高,水解程度越大(2分)
(5)抑制Zn2+水解为Zn(OH)2 (2分)
蒸发皿、酒精灯、铁架台、玻璃棒(4分)
试题分析:根据题意知,“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩、冷却结晶,得到Zn(NO3)2?6H2O晶体。(1)烂板液”中溶质的主要成分是Zn(NO3)2,稀硝酸腐蚀锌板产生N2O、硝酸锌和水,化学方程式为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;(2)在操作①中保持pH=8的目的是使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解,答案为:防止生成的Zn(OH)2溶解;(3)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,答案为:Fe(OH)3、Zn(OH)2;(4)加热、煮沸促使Fe3+完全水解,原理是温度越高,水解程度越大,答案为:促使Fe3+完全水解、温度越高,水解程度越大;(5)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,操作④包括蒸发浓缩,冷却结晶,过滤,所用的主要仪器有蒸发皿、酒精灯、铁架台、玻璃棒,答案为:抑制Zn2+水解生成Zn(OH)2;蒸发皿、酒精灯、铁架台、玻璃棒。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

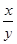 =_____。
=_____。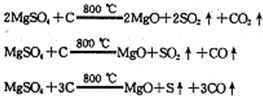
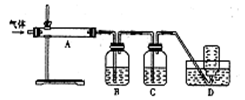
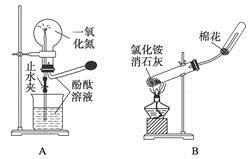
 )
)