��Ŀ����
ijУһ��ѧʵ��С��ͨ��ʵ�������ȷ��һ��ɫ��ĩΪFe2O3��Cu2O�Ļ���
��֪:��Cu2O����ϡ��������Cu��CuSO4,��Cu2O�ڿ����м�������CuO��
(1)ʵ��С�����ü��ȷ��ⶨCu2O������������ȡa g�����ĩ�ڿ����г�ּ��ȣ����������ٱ仯ʱ����������Ϊb g(b>a)����������Cu2O����������Ϊ__________��
(2)ʵ��С�������øú�ɫ��ĩ��ȡ�ϴ����ĵ���(CuSO4��5H2O)�����������ϵ�֪��
����Һ��ͨ��������Һ������Զ�ʹCu2����Fe2����Fe3���ֱ����ɳ�����pH���£�
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | ��ѡ���Լ� | |
| Fe3+ | 1.9 | 3.7 | A.��ˮ�� B.H2O2�� C.NaOH�� D.��ˮ�� E.CuO���� F.Cu2(OH)2CO3 |
| Fe2+ | 7.5 | 11 | |
| Cu2+ | 6.0 | 10 |
ʵ��С���������ͼʵ�鷽����
�Իش�
���Լ�1����Ϊ________________��
�Լ�2����Ϊ________________��
�ڹ���X�Ļ�ѧʽΪ____________��
�۲�����Ϊ____________________��

(1)![]() ��100%��3�֣�
��100%��3�֣�
(2)��B;��1�֣� EF����2�֣� ��Fe(OH)3��1�֣� ������Ũ������ȴ�ᾧ��2�֣�

I��ijУ��ѧʵ��С��̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬���ⶨ![]() ��KI��Ӧ�Ļ�ѧ��Ӧ���ʡ���������ʵ��̽����
��KI��Ӧ�Ļ�ѧ��Ӧ���ʡ���������ʵ��̽����
��ʵ��ԭ����
![]() ��KI��Ӧ�����ӷ���ʽΪ��
��KI��Ӧ�����ӷ���ʽΪ��
![]() ��1��
��1��
ƽ����Ӧ���ʵļ���ʽΪ![]() ��
��
ʵ��ʱ����![]() ��
��![]() �͵���ָʾ�������Һ�м���
�͵���ָʾ�������Һ�м���![]() ��Һ�����Ͻ��衣�ڷ�Ӧ��1�����е�ͬʱ��������Ӧ��
��Һ�����Ͻ��衣�ڷ�Ӧ��1�����е�ͬʱ��������Ӧ��
![]() ��2��
��2��
��Ӧ��1�����ɵ�![]() ������
������![]() ��Ӧ��������ɫ��
��Ӧ��������ɫ��![]() ��
��![]() ��
��![]() �ľ�ʱ����Ӧ��1���������ɵ�
�ľ�ʱ����Ӧ��1���������ɵ�![]() ����������ó�����ɫ���Ӽ���
����������ó�����ɫ���Ӽ���![]() ��Һ��������ɫ��ʱ��Ϊ
��Һ��������ɫ��ʱ��Ϊ![]() ��
��
��ʵ�����ݡ�
��1��ʵ��С����Ƶ�ʵ���¼�������ݼ�¼���£��뽫������ĸ��ʾ�Ŀո����ϡ�
| ʵ���� | ��[��Դ:Z��xx��k.Com] | �� | �� | �� | �� | |
| �Լ�[��Դ:ѧ&��&��Z&X&X ���� ��mL�� | 0��20 mol��L | 20��0 | 10��0[ | b | 20��0 | 20��0 |
| 0��20 mol��L | 20��0 | 20��0 | 20��0 | 10��0 | 5��0 | |
| 0��010 mol��L | a | 8��0 | 8��0 | 8��0 | 8��0 | |
| 0��2%������Һ | 2��0 | 2��0 | 2��0 | 2��0 | 2��0 | |
| 0��20 mol��L | 0 | 0 | 0 | 10��0 | c | |
| 0��20 mol��L | 0 | 10��0 | 15��0 | 0 | 0 | |
| 20��ʱ����Ӧʱ�� | 32 | 67 | 130 | 66 | 135 | |
| Ϊ��ʹ��Һ������ǿ�Ⱥ���������ֲ��䣬���ٵģ�NH4��2S2O8��Һ��KI��Һ���������ֱ��ã�NH4��2SO4��Һ��KNO3��Һ���㣻��Һ��Ϻ�������� | ||||||
��2��Ϊ��ʹ��Ӧ��ֽ��У�����������ʵ�������Ӧ�ò��Ͻ��еIJ����� ��
��3���ڢ���ʵ���![]() mol����L��s��
mol����L��s��![]() ��
��
��4�������ϱ����ݷ��������Եõ��Ľ����У�д��һ�����ɣ� ��
II��ʵ��С������ϵ�֪������NaCO3��Na2S��Һ��ͨ��SO2�������Ʊ�����ʵ�������Na2S2O3����Ӧ���£�
![]()
![]()
![]()
��С���������ԭ�������ͼ19��ʾװ���Ʊ�![]() ��
��
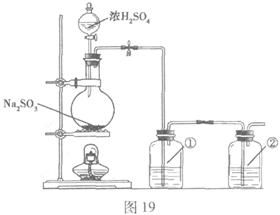
��1��ʵ��Ӧ�����к������ŷŵ������С�װ�â١�����ʢ�ŵ��Լ������Ǣ� ��
�� ��
��2��ʵ������У����������ͨ�룬װ�â����д�����ɫ��������������ͨ�����壬���Թ۲쵽�������� ��
��3����Ӧ�������Ƶõ�![]() ϡ��Һ�еõ�
ϡ��Һ�еõ�![]() �������Ҫ���������� ��
�������Ҫ���������� ��
I��ijУ��ѧʵ��С��̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬���ⶨ![]() ��KI��Ӧ�Ļ�ѧ��Ӧ���ʡ���������ʵ��̽����
��KI��Ӧ�Ļ�ѧ��Ӧ���ʡ���������ʵ��̽����
��ʵ��ԭ����
![]() ��KI��Ӧ�����ӷ���ʽΪ��
��KI��Ӧ�����ӷ���ʽΪ��
![]() (1)
(1)
ƽ����Ӧ���ʵļ���ʽΪ![]() ��
��
ʵ��ʱ����![]() ��
��![]() �͵���ָʾ�������Һ�м���
�͵���ָʾ�������Һ�м���![]() ��Һ�����Ͻ��衣
��Һ�����Ͻ��衣
�ڷ�Ӧ(1)���е�ͬʱ��������Ӧ��
![]() (2)
(2)
��Ӧ(1)���ɵ�![]() ������
������![]() ��Ӧ��������ɫ��
��Ӧ��������ɫ��![]() ��
��![]() ��
��![]() �ľ�ʱ����Ӧ(1)�������ɵ�
�ľ�ʱ����Ӧ(1)�������ɵ�![]() ����������ó�����ɫ���Ӽ���
����������ó�����ɫ���Ӽ���![]() ��Һ��������ɫ��ʱ��Ϊ
��Һ��������ɫ��ʱ��Ϊ![]() ��
��
��ʵ�����ݡ�
��1��ʵ��С����Ƶ�ʵ���¼�������ݼ�¼���£��뽫������ĸ��ʾ�Ŀո����ϡ�
| ʵ���� | �� | �� | �� | �� | �� | |
| �Լ� ���� ��mL�� | 0.20 mol��L | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol��L | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol��L | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2%������Һ | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol��L | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol��L | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20��ʱ����Ӧʱ�� | 32 | 67 | 130 | 66 | 135 | |
| Ϊ��ʹ��Һ������ǿ�Ⱥ���������ֲ��䣬���ٵ�(NH4)2S2O8��Һ��KI��Һ���������ֱ���(NH4)2SO4��Һ��KNO3��Һ���㣻��Һ��Ϻ�������� | ||||||
��2��Ϊ��ʹ��Ӧ��ֽ��У�����������ʵ�������Ӧ�ò��Ͻ��еIJ����� ��
��3���ڢ���ʵ���![]() mol��(L��s)
mol��(L��s)![]() ��
��
��4�������ϱ����ݷ��������Եõ��Ľ�����(д��һ������) ��
II��ʵ��С������ϵ�֪������NaCO3��Na2S��Һ��ͨ��SO2�������Ʊ�����ʵ�������Na2S2O3����Ӧ���£�
![]()
![]()
![]()
��С���������ԭ�������ͼ19��ʾװ���Ʊ�![]() ��
��
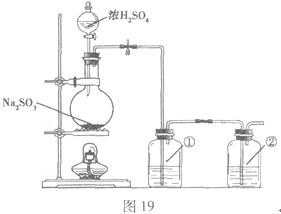
��1��ʵ��Ӧ�����к������ŷŵ������С�װ�â١�����ʢ�ŵ��Լ������Ǣ� ���� ��
��2��ʵ������У����������ͨ�룬װ�â����д�����ɫ��������������ͨ�����壬���Թ۲쵽�������� ��
��3����Ӧ�������Ƶõ�![]() ϡ��Һ�еõ�
ϡ��Һ�еõ�![]() �������Ҫ���������� ��
�������Ҫ���������� ��
��13�֣�I��ijУ��ѧʵ��С��̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬���ⶨ(NH4)2S2O8��KI��Ӧ�Ļ�ѧ��Ӧ���ʡ���������ʵ��̽����
��ʵ��ԭ����
(NH4)2S2O8��KI��Ӧ�����ӷ���ʽΪ��S2O82�� + 2I��= 2SO42�� + I2 ��1��
ƽ����Ӧ���ʵļ���ʽΪv(S2O82��)= ��
ʵ��ʱ����KI��Na2S2O3�͵���ָʾ�������Һ�м���(NH4)2S2O8��Һ�����Ͻ��衣
�ڷ�Ӧ��1�����е�ͬʱ��������Ӧ��2S2O32��+ I2 = S4O62��+ 2I�� ��2��
��Ӧ(1)���ɵ�I2������S2O32����Ӧ��������ɫ��S4O62����I����S2O32���ľ�ʱ����Ӧ��1���������ɵ�I2����������ó�����ɫ���Ӽ���(NH4)2S2O8��Һ��������ɫ��ʱ��Ϊ��t��
��ʵ�����ݡ�
��1��ʵ��С����Ƶ�ʵ���¼�������ݼ�¼���£��뽫������ĸ��ʾ�Ŀո����ϡ�
| ʵ �� �� �� | �� | �� | �� | �� | �� | |
|
�Լ� ���� (mL) | 0.20 mol��L-1 (NH4)2S2O8��Һ | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol��L-1 KI��Һ | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol��L-1 Na2S2O3��Һ | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% ������Һ | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol��L-1KNO3��Һ | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol��L-1(NH4)2SO4��Һ | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20 ��ʱ����Ӧʱ�䦤t��s�� | 32 | 67 | 130 | 66 | 135 | |
| Ϊ��ʹ��Һ������ǿ�Ⱥ���������ֲ��䣬���ٵ�(NH4)2S2O8��Һ��KI��Һ���������ֱ���(NH4)2SO4��Һ��KNO3��Һ���㣻��Һ��Ϻ�������� |
��2��Ϊ��ʹ��Ӧ��ֽ��У�����������ʵ�������Ӧ�ò��Ͻ��еIJ����� ��
��3���ڢ���ʵ���v(S2O82��)= mol��(L��s)-1��
��4�������ϱ����ݷ��������Եõ��Ľ����У�д��һ�����ɣ�
��
II��ʵ��С������ϵ�֪������Na2CO3��Na2S��Һ��ͨ��SO2�������Ʊ�����ʵ�������Na2S2O3����Ӧ���£�Na2CO3+ SO2= Na2SO3 + CO2��2Na2S + 3SO2= 2Na2SO3 + 3S����
Na2SO3 + S= Na2S2O3����С���������ԭ�������ͼ��ʾװ���Ʊ�Na2S2O3��
��1��ʵ��Ӧ�����к������ŷŵ������С�װ�â١�����ʢ�ŵ��Լ�������
�� ��
�� ��
��2��ʵ������У����������ͨ�룬װ�â��������ݲ��������д�����ɫ��������������ͨ�����壬���Թ۲쵽�������� ��
��3����Ӧ�������Ƶõ�Na2S2O3ϡ��Һ�еõ�Na2S2O3��5H2O�������Ҫ���������� ��
ijУ��ѧʵ��С��ͬѧ�����й�NO2�����ϵ��ʵ�顣
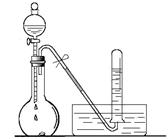
��1������ͼ��ʾ����ƿ�з�������ͭƬ����Һ©��
���������������Ũ���ᣬ��ƿ�в����������ɫ�� ���Թ����ռ���������ɫ�� ���û�ѧ����ʽ��ʾ��ԭ�� ��
��2������ƿ�����ˮ�У���ƿ��������ɫ �������������䡱��dz������ʹ�û�ѧ����ͱ�Ҫ������˵����ɫ�仯��ԭ�� ��
��3����80��ʱ����0.40 mol N2O4�������2 L�Ѿ���յĹ̶��ݻ����ܱ������з�����Ӧ����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
|
ʱ�䣨s�� |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4)/mol |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2)/mol |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
�ټ���a = �����¶�ʱ�÷�Ӧ��ƽ�ⳣ��K= ��
��ƽ�������������ٳ���0.2molN2O4���壬��N2O4��ת���� ��������С�䣩
�۸ı�����ʹ��Ӧ���´ﵽƽ�⣬��ʹc(NO2)/c(N2O4)ֵ��С�Ĵ�ʩ�У�����ţ� ��
A������N2O4����ʼŨ�� B�������¶�
C��ʹ�ø�Ч���� D������������ͨ��ϡ������
| �������й�ʵ�����������ȷ����____������ţ��� �����������Һ�ζ����������������Һʱ��ˮϴ�����ʽ�ζ���δ������Һ��ϴ����ⶨ���ƫ�͡� �� ����һ�����ʵ���Ũ�ȵ���Һʱ����������ƿ�Ŀ̶��ߣ���ʹ���Ƶ�Ũ��ƫ�ߣ� �� ��Fe2(SO4)3��Һ�����������ɲ����գ����õ�����ɫ��ĩ �� ����ع�������Һ��ȴδ���ֽᾧʱ�������ò������ĥ������ڴ�ʹ���������� �ݿ���25ml��ʽ�ζ�����ȡ20.00mlKMnO4��Һ �ֱ��������pH����ͬ������ʹ����еμӵ�Ũ�ȵ�����������Һ����ȫ�к�ʱ���ĵ�����������Һ�����һ���� ��������������������ͭ���Ǻ�ɫ��ĩ�����������ϡ�ijУһ��ѧʵ��С��ͨ ��ʵ����̽����ɫ��ĩ��Fe2O3��Cu2O�������̽���������£� �������ϣ�Cu2O��һ�ּ������������ϡ��������Cu��CuSO4���ڿ����м�������CuO�� ������� ����1����ɫ��ĩ��Fe2O3 ����2����ɫ��ĩ��Cu2O ����3����ɫ��ĩ��Fe2O3��Cu2O�Ļ���� ���̽��ʵ�� ȡ������ĩ��������ϡ�����У���������Һ���ٵμ�KSCN�Լ��� ��1��������1��������ʵ��������_________________�� ��2�����μ�KSCN�Լ�����Һ�����ɫ����֤��ԭ�����ĩ��һ����������������������Ϊ����˵��������?_________________�������������(����д����Ӧ�ķ���ʽ)___________________�� ��3���������ĩ��ȫ�ܽ�������ڣ��μ�KSCN�Լ�ʱ��Һ�����ɫ����֤��ԭ�����ĩ��____________��д��������Ӧ�����ӷ���ʽ________________�� ̽������ ��ʵ�������ȷ����ɫ��ĩΪFe2O3��Cu2O�Ļ��� ��4��ʵ��С�����ü��ȷ��ⶨCu2O������������ȡag�����ĩ�ڿ����г�ּ��ȣ����������ٱ仯ʱ����������Ϊbg(b>a)����������Cu2O����������Ϊ________�� ��5��ʵ��С�������øú�ɫ��ĩ��ȡ�ϴ����ĵ���(CuSO4��5H2O)�����������ϵ�֪������Һ��ͨ��������Һ������Զ�ʹCu2+��Fe2+��Fe3+�ֱ����ɳ�����pH���£� | ||||||||||||
| ||||||||||||
| ʵ�����������Լ��ɹ�ѡ�� A����ˮ B��H2O2 C��NaOH D��Cu2(OH)2CO3 ʵ��С��������·��� | ||||||||||||
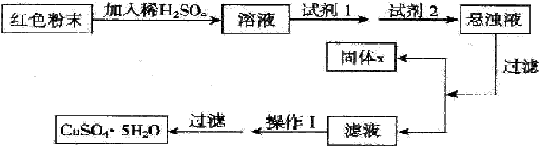 | ||||||||||||
| �Իش� ���Լ�1Ϊ_______���Լ�2Ϊ________(����ĸ)�� �ڹ���X�Ļ�ѧʽΪ____________�� �۲���IΪ___________�� |