题目内容
(2011?双流县模拟)将a mol Cu2S与b mol FeS的混合粉末投入到V mL、c mol/L的硝酸溶液中恰好完全反应,生成d L NO气体,所得溶液可看作是硝酸铜、硝酸铁和硫酸的混合溶液,则反应中被还原的硝酸可能是( )
分析:根据氧化还原反应中电子守恒来确定被还原的硝酸的量,此外被还原的硝酸全部转化为一氧化氮,可以根据一氧化氮的物质的量来确定被还原的硝酸的物质的量的多少,未被还原的硝酸均显示了酸性,可以根据原子守恒的电子守恒的思想来计算回答.
解答:解:由元素守恒知:未被还原的硝酸将转化为硝酸铜、硝酸铁中的硝酸根离子,所以显酸性的硝酸的物质的量等于硝酸根的物质的量的3倍,
由元素守恒知,n〔Fe(NO3)3〕=n(Fe)=bmol,n〔Cu(NO3)2〕=n(Cu)=amol,所以未被还原的硝酸的物质的量为3b+2a,被还原的硝酸的物质的量是(0.001cV-2a-3b)mol,
又根据电子守恒知:amolCu2S→2amolCu(NO3)2+amolH2SO4,化合价升高了:2a+8a=10a,bmolFeS→bmolFe(NO3)3+bmolH2SO4,化合价升高了b+8b=9b,设反应中被还原的硝酸是xmol,则xHNO3→xNO,化合价降低了3x,所以3x=10a+9b,即x=
;此外被还原的硝酸全部转化为一氧化氮,所以二者的物质的量是相等的,所以应中被还原的硝酸可能是
mol.
故选AD.
由元素守恒知,n〔Fe(NO3)3〕=n(Fe)=bmol,n〔Cu(NO3)2〕=n(Cu)=amol,所以未被还原的硝酸的物质的量为3b+2a,被还原的硝酸的物质的量是(0.001cV-2a-3b)mol,
又根据电子守恒知:amolCu2S→2amolCu(NO3)2+amolH2SO4,化合价升高了:2a+8a=10a,bmolFeS→bmolFe(NO3)3+bmolH2SO4,化合价升高了b+8b=9b,设反应中被还原的硝酸是xmol,则xHNO3→xNO,化合价降低了3x,所以3x=10a+9b,即x=
| 10a+9b |
| 3 |
| d |
| 22.4 |
故选AD.
点评:本题是一道有关关氧化还原反应中电子守恒知识的综合考查题,注意电子守恒思想的灵活应用,题目综合性强,难度大.

练习册系列答案
相关题目
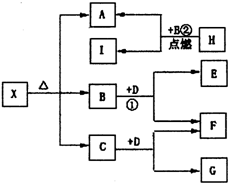 (2011?双流县模拟)如图为一些常见无机物之间的转化关系,已知X是-种盐,H是金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题:
(2011?双流县模拟)如图为一些常见无机物之间的转化关系,已知X是-种盐,H是金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题: