题目内容
某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管.请填写下列空白: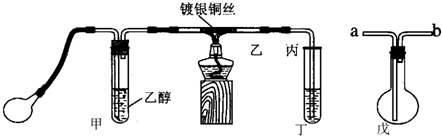
(1)甲装置常常浸在温度为70~80℃的水浴中,目的是
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜可丝即呈红热状态.若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束.
(3)乙醇的催化氧化反应是
(4)①在实验过程中控制鼓气的速度很重要:①控制鼓气速度的方法是
②若鼓气速度过快反应会停止,原因:
③若鼓气速度过慢反应也会停止,原因:
(5)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接
分析:(1)加热时采用水浴加热可以让乙醇平稳气化成乙醇蒸气;
(3)该反应引发后,不需加热即可进行,说明反应是放热的;乙醇催化氧化可以生成乙醛;
(4)①根据甲中单位时间内的气泡数来控制气流;
②若鼓气速度过快,带走过多热量,难以保证反应所需温度;
③若鼓气速度过慢,氨的催化氧化反应放热太少,达不到反应所需温度反应停止;
(5)安全瓶中的导管是“短进长出”.
(3)该反应引发后,不需加热即可进行,说明反应是放热的;乙醇催化氧化可以生成乙醛;
(4)①根据甲中单位时间内的气泡数来控制气流;
②若鼓气速度过快,带走过多热量,难以保证反应所需温度;
③若鼓气速度过慢,氨的催化氧化反应放热太少,达不到反应所需温度反应停止;
(5)安全瓶中的导管是“短进长出”.
解答:解:(1)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气,
故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;
(3)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应;乙醇发生催化氧化2CH3CH2OH+O2
2CH3CHO+2H2O,生成乙醛和水,
故答案为:放热;2CH3CH2OH+O2
2CH3CHO+2H2O;
(4)①甲中单位时间内的气泡数越多,气流速度越大,反之越小,故答案为:控制甲中单位时间内气泡数;
②若鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度,导致反应停止,故答案为:带走过多热量,难以保证反应所需温度;
③若鼓气速度过慢,氨的催化氧化反应放热太少,达不到反应所需温度反应停止,故答案为:反应放热太少,不能达到反应需要温度;
(5)为防止防止丁中水倒吸,安全瓶中的导气管是“短进长出”,所以戊装置有缓冲作用,故答案为:b;a.
故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;
(3)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应;乙醇发生催化氧化2CH3CH2OH+O2
| 催化剂 |
| 加热 |
故答案为:放热;2CH3CH2OH+O2
| 催化剂 |
| 加热 |
(4)①甲中单位时间内的气泡数越多,气流速度越大,反之越小,故答案为:控制甲中单位时间内气泡数;
②若鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度,导致反应停止,故答案为:带走过多热量,难以保证反应所需温度;
③若鼓气速度过慢,氨的催化氧化反应放热太少,达不到反应所需温度反应停止,故答案为:反应放热太少,不能达到反应需要温度;
(5)为防止防止丁中水倒吸,安全瓶中的导气管是“短进长出”,所以戊装置有缓冲作用,故答案为:b;a.
点评:本题考查了乙醇的催化氧化实验,掌握乙醇的化学性质以及乙醇的催化氧化实验操作时解答的关键,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目