题目内容
某溶液中含有大量的下列离子:Fe3+、SO42ˉ、A13+和M离子,经测定Fe3+、SO42-、A13+和M离子的物质的量之比为2:3:1:3,则M离子可能是下列中的
| A.Na+ | B.OHˉ | C.S2ˉ | D.C1ˉ |
D
试题分析:阳离子所带电荷的物质的量为3×n(Fe3+)+3×n(Al3+)=3×2+3×1=9,阴离子所带电荷的物质的量为2×n(SO42-)=2×3=6,根据电荷守恒可知M为阴离子,又知M的物质的量为3,所以M为负一价阴离子,为OHˉ或C1ˉ,因为OHˉ不能与Fe3+和A13+共存,所以只能是C1ˉ。答案选D。
点评:判断的关键是离子共存,直接可以排除B、C选项。然后根据电荷守恒得出是阴离子,选D。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
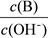 ②
②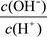 ③c(H+)
③c(H+)