题目内容
草酸(H2C2O4)是一种有机二元酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α(H2C2O4-α,HC2O4--α1,C2O42--α2)随溶液pH变化的关系如图所示.(1)草酸钠溶液中,
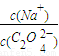 2(填“>”“═”或“<”);往该溶液中滴入氯化钙溶液后,
2(填“>”“═”或“<”);往该溶液中滴入氯化钙溶液后,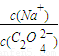 增加,可能的原因是 .
增加,可能的原因是 .(2)往草酸钠溶液中滴稀盐酸,pH=5时溶液中存在的阴离子有 ,pH=3时,以上两种物质发生的主要反应的离子方程式为 .
(3)菠菜富含草酸,菠菜不能与牛奶、豆腐一起食用的原因是 .
(4)将适量草酸亚铁粉末加入试管中,在酒精灯上边加热边摇动,发生剧烈反应,产生的气体可使燃着木条熄灭,同时生成黑色粉末.反应即将结束时,将所得的黑色粉末撒在石棉网上,便会立即自燃起来.草酸亚铁粉末受热分解的化学方程式为 ,自燃的原因是 .
(5)下表为几种酸对铁锈及锅炉水垢的溶解性比较:
| 酸 | 铁锈[Fe(OH)3]溶解量/g | 水垢(CaCO3)溶解量/g |
| 盐酸 | 0.7911 | 全溶 |
| 磷酸 | 0.1586 | 微溶 |
| 草酸 | 0.7399 | 0.0036 |
| 醋酸 | 0.1788 | 0.1655 |
A.同物质的量浓度时,酸性越强的酸除铁锈效果越好
B.草酸除水垢效果差的原因是因为草酸酸性太弱
C.铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关
D.硫酸除铁锈和水垢的效果都好.

【答案】分析:(1)草酸钠中的草酸根离子是弱酸阴离子,易水解,C2O42-与Ca2+形成沉淀;
(2)往草酸钠溶液中滴稀盐酸,当pH=5时根据各形态的浓度分数α(H2C2O4-α,HC2O4--α1,C2O42--α2)随溶液pH变化的关系图来确定存在的离子,根据图示内容确定PH=3时存在的离子,并确定发生的反应;
(3)菠菜富含草酸,牛奶、豆腐含有钙离子,二者混吃会产生草酸钙沉淀;
(4)草酸亚铁受热分解为金属铁、二氧化碳以及水蒸气,反应的产物在温度较高时会自燃;
(5)A、磷酸是中强酸,醋酸以及草酸是弱酸,根据表中的数据来回答;
B、C2O42-与Ca2+形成沉淀阻止水垢的溶解;
C、铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关;
D、硫酸和水垢反应生成的硫酸钙是微溶的,不利于除垢.
解答:解:(1)草酸钠中的草酸根离子是弱酸阴离子,易水解,所以草酸钠溶液中,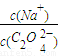 >2,该草酸钠溶液中滴入氯化钙溶液后,C2O42-与Ca2+形成沉淀,所以C2O42-浓度降低,
>2,该草酸钠溶液中滴入氯化钙溶液后,C2O42-与Ca2+形成沉淀,所以C2O42-浓度降低,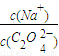 增加,故答案为:>;C2O42-与Ca2+形成沉淀;
增加,故答案为:>;C2O42-与Ca2+形成沉淀;
(2)往草酸钠溶液中滴稀盐酸,当pH=5时根据各形态的浓度分数α(H2C2O4-α,HC2O4--α1,C2O42--α2)随溶液pH变化的关系图,可以确定存在的离子有C2O42-、HC2O4-、OH-、Cl-,根据图示内容确定PH=3时存在的离子有HC2O4-、OH-、Cl-,可以知道酸性增强所发生的反应为C2O42-+H+=HC2O4-,故答案为:C2O42-、HC2O4-、OH-、Cl-;C2O42-+H+=HC2O4-;
(3)菠菜富含草酸,牛奶、豆腐含有钙离子,二者混吃会生成草酸钙沉淀,使钙流失,
故答案为:生成草酸钙沉淀,使钙流失;
(4)草酸亚铁受热分解为金属铁、二氧化碳以及水蒸气,即FeC2O4?H2O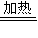 Fe+2CO2↑+H2O↑,反应即将结束时,将所得的黑色粉末撒在石棉网上,由于温度高,且铁的颗粒很小,与空气接触面大,反应速率快而会自燃,
Fe+2CO2↑+H2O↑,反应即将结束时,将所得的黑色粉末撒在石棉网上,由于温度高,且铁的颗粒很小,与空气接触面大,反应速率快而会自燃,
故答案为:FeC2O4?H2O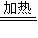 Fe+2CO2↑+H2O↑;温度高,且铁的颗粒很小,与空气接触面大,反应速率快;
Fe+2CO2↑+H2O↑;温度高,且铁的颗粒很小,与空气接触面大,反应速率快;
(5)A、磷酸是中强酸,醋酸以及草酸是弱酸,根据表中的数据,同物质的量浓度时,酸性越强的磷酸除铁锈效果不如草酸,故A错误;
B、草酸除水垢效果差的原因是C2O42-与Ca2+形成沉淀阻止水垢的溶解,减慢反应速率,故B错误;
C、铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关,故C正确;
D、硫酸和水垢反应生成的硫酸钙是微溶的,阻止水垢的溶解,不利于除垢,故D错误.
故选C.
点评:本题考查学生弱电解质的电离平衡知识,可以根据教材知识来回答,难度较大.
(2)往草酸钠溶液中滴稀盐酸,当pH=5时根据各形态的浓度分数α(H2C2O4-α,HC2O4--α1,C2O42--α2)随溶液pH变化的关系图来确定存在的离子,根据图示内容确定PH=3时存在的离子,并确定发生的反应;
(3)菠菜富含草酸,牛奶、豆腐含有钙离子,二者混吃会产生草酸钙沉淀;
(4)草酸亚铁受热分解为金属铁、二氧化碳以及水蒸气,反应的产物在温度较高时会自燃;
(5)A、磷酸是中强酸,醋酸以及草酸是弱酸,根据表中的数据来回答;
B、C2O42-与Ca2+形成沉淀阻止水垢的溶解;
C、铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关;
D、硫酸和水垢反应生成的硫酸钙是微溶的,不利于除垢.
解答:解:(1)草酸钠中的草酸根离子是弱酸阴离子,易水解,所以草酸钠溶液中,
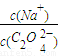 >2,该草酸钠溶液中滴入氯化钙溶液后,C2O42-与Ca2+形成沉淀,所以C2O42-浓度降低,
>2,该草酸钠溶液中滴入氯化钙溶液后,C2O42-与Ca2+形成沉淀,所以C2O42-浓度降低,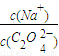 增加,故答案为:>;C2O42-与Ca2+形成沉淀;
增加,故答案为:>;C2O42-与Ca2+形成沉淀;(2)往草酸钠溶液中滴稀盐酸,当pH=5时根据各形态的浓度分数α(H2C2O4-α,HC2O4--α1,C2O42--α2)随溶液pH变化的关系图,可以确定存在的离子有C2O42-、HC2O4-、OH-、Cl-,根据图示内容确定PH=3时存在的离子有HC2O4-、OH-、Cl-,可以知道酸性增强所发生的反应为C2O42-+H+=HC2O4-,故答案为:C2O42-、HC2O4-、OH-、Cl-;C2O42-+H+=HC2O4-;
(3)菠菜富含草酸,牛奶、豆腐含有钙离子,二者混吃会生成草酸钙沉淀,使钙流失,
故答案为:生成草酸钙沉淀,使钙流失;
(4)草酸亚铁受热分解为金属铁、二氧化碳以及水蒸气,即FeC2O4?H2O
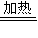 Fe+2CO2↑+H2O↑,反应即将结束时,将所得的黑色粉末撒在石棉网上,由于温度高,且铁的颗粒很小,与空气接触面大,反应速率快而会自燃,
Fe+2CO2↑+H2O↑,反应即将结束时,将所得的黑色粉末撒在石棉网上,由于温度高,且铁的颗粒很小,与空气接触面大,反应速率快而会自燃,故答案为:FeC2O4?H2O
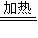 Fe+2CO2↑+H2O↑;温度高,且铁的颗粒很小,与空气接触面大,反应速率快;
Fe+2CO2↑+H2O↑;温度高,且铁的颗粒很小,与空气接触面大,反应速率快;(5)A、磷酸是中强酸,醋酸以及草酸是弱酸,根据表中的数据,同物质的量浓度时,酸性越强的磷酸除铁锈效果不如草酸,故A错误;
B、草酸除水垢效果差的原因是C2O42-与Ca2+形成沉淀阻止水垢的溶解,减慢反应速率,故B错误;
C、铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关,故C正确;
D、硫酸和水垢反应生成的硫酸钙是微溶的,阻止水垢的溶解,不利于除垢,故D错误.
故选C.
点评:本题考查学生弱电解质的电离平衡知识,可以根据教材知识来回答,难度较大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目



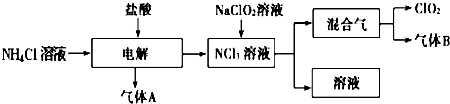
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.