题目内容
某稀溶液中含有Fe(NO3)3.Cu(NO3)2.HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系入右图所示,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
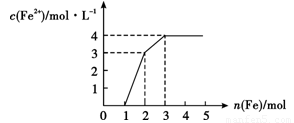
A.1:1:1 B.1:3:1 C.3:3:8 D.1:1:4
【答案】
D
【解析】三种物质的氧化性强弱顺序是硝酸、硝酸铁、硝酸铜。所以反应的先后顺序是Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、2Fe(NO3)3+Fe=3Fe(NO3)2、Cu(NO3)2+Fe=Fe(NO3)2+Cu。所以根据图像可知硝酸的物质的量是4mol、生成硝酸铁1mol,则原溶液中的硝酸铁是1mol,而硝酸铜也是1mol,答案选D。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 (2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
(2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( ) 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.当加入1.5mol铁粉并充分反应后的溶液中Fe(NO3)3、Fe(NO3)2、Cu(NO3)2物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.当加入1.5mol铁粉并充分反应后的溶液中Fe(NO3)3、Fe(NO3)2、Cu(NO3)2物质的量浓度之比为( )
