题目内容
【题目】实验室制取少量的乙烯时,常利用乙醇和浓硫酸快速加热到170℃来制取。此实验常因温度过高而发生副反应。有部分乙醇跟浓H2SO4反应生成SO2、C02、水蒸气和炭黑。
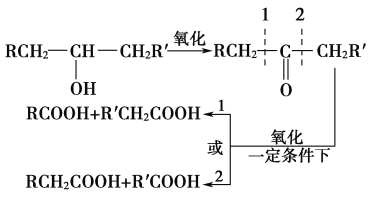
I.用方程式表示乙烯制备的反应原理____;乙烯制备时,在140℃常伴随有副反应发生,化学方程式为_____。
Ⅱ.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试完成下列问题:
(1)图中①②③④装置可盛放的试剂是(试剂可重复使用,也可不使用):(填写ABCD)
①_____;②____;③_____;④______。
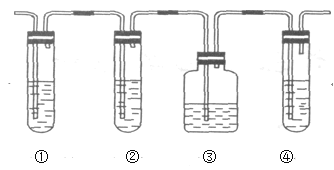
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是______。
(3)使用装置②的目的是___________。
(4)使用装置③的目的是______________。
(5)确证含有乙烯的现象是_______________
【答案】CH3CH2OH![]() CH2=CH2↑+H2O 2CH3CH2OH
CH2=CH2↑+H2O 2CH3CH2OH![]() CH3CH2-O-CH2CH3+H2O A B A D ①中品红褪色 除去SO2 检验SO2是否除尽 ③中品红不褪色,④中酸性KMnO4溶液褪色
CH3CH2-O-CH2CH3+H2O A B A D ①中品红褪色 除去SO2 检验SO2是否除尽 ③中品红不褪色,④中酸性KMnO4溶液褪色
【解析】
I.实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,发生消去反应;
Ⅱ.根据二氧化硫和乙烯的性质的异同设计检验方案,二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与酸性高锰酸钾、溴水发生氧化还原反应,而乙烯含有碳碳双键,可与溴水发生加成反应,与酸性高锰酸钾发生氧化还原反应。
I.乙醇在浓硫酸的催化作用下,加热到170℃发生分子内脱水生成乙烯,反应的化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O;在140℃时,乙醇发生分子间脱水生成乙醚,反应的化学方程式为2CH3CH2OH
CH2=CH2↑+H2O;在140℃时,乙醇发生分子间脱水生成乙醚,反应的化学方程式为2CH3CH2OH![]() CH3CH2-O-CH2CH3+H2O,故答案为:CH3CH2OH
CH3CH2-O-CH2CH3+H2O,故答案为:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2-O-CH2CH3+H2O;
CH3CH2-O-CH2CH3+H2O;
Ⅱ.(1)检验SO2选用品红溶液,检验乙烯可选用酸性高锰酸钾溶液,但SO2也能使酸性高锰酸钾溶液褪色,所以先检验SO2,将SO2除尽后再检验乙烯,所以装置①用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置②试管装有NaOH溶液除去SO2,装置③试管通过品红溶液不褪色确认SO2已除干净,装置④通过酸性高锰酸钾溶液褪色检验乙烯,故答案为:A;B;A;D;
(2)装置①试管中品红溶液褪色,能说明二氧化硫气体存在,故答案为:①中品红褪色;
(3)装置②试管装有NaOH溶液,使用装置②的目的是除去SO2,以免干扰乙烯的检验,故答案为:除去SO2;
(4)装置③的目的是通过品红溶液不褪色,确认SO2已除干净,故答案为:检验SO2是否除尽;
(5)装置④通过酸性高锰酸钾溶液褪色检验乙烯,如果③中的品红不褪色,④中的酸性高锰酸钾溶液褪色,则证明有乙烯生成,故答案为:③中品红不褪色,④中酸性KMnO4溶液褪色。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为K1=__________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
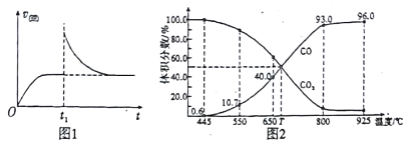
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是_________。
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如下图所示( 导电壳内部为纳米零价铁)。
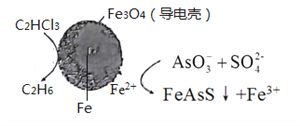
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。