题目内容
某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究.请完成下列探究报告.探究目的:探究该焰火原料的组成
资料检索:
①Mg2+检验的方法:取2滴待检液,加入2滴2mol?L-1NaOH溶液,再加入2滴镁试剂(I)染料(对硝基苯偶氮苯二酚).若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有Mg2+.(注:Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+的检测)
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液.
③很多合金是金属互化物,有确定的化学组成.
探究思路:①确定该焰火原料所含金属种类;②测定该火焰原料的化学式.
实验探究:(1)甲同学进行了初步实验,实验步骤和实验现象如下.请填写下表
| 试验序号 | 实验步骤 | 实验现象 | 结论 |
| ① | 取少量该焰火原料, 加入冷水 | 无明显现象 | ______ |
| ② | 取少量该焰火原料, 加入足量稀盐酸 | 完全溶解,有大量气体 产生、溶液呈无色 | ______ |
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下
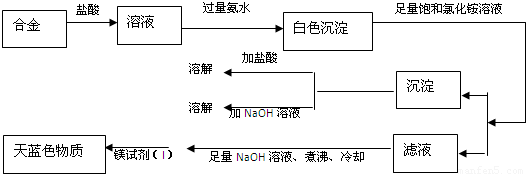
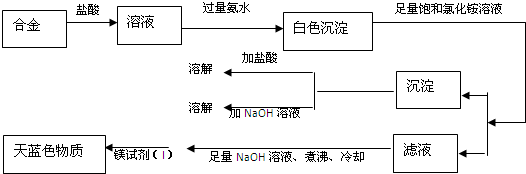
由丙同学的实验记录可知该焰火原料是由______和______两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸的理由是______.
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成.

问题讨论:
①能确定合金组成的数据组有______(填写选项字母).
A.m、n B.m、y C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol.试在右图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为______.
【答案】分析:(1)①Na、Li等活泼金属和与水反应;
②能与盐酸反应为较活泼的金属;
(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀;
(3)由题给信息可知Mg(OH)2可溶于浓的氯化铵溶液,应排除NH4+的干扰;
(4)①镁和铝都能与盐酸反应生成氢气,根据氢气的体积结合合金总质量可确定合金的组成,加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,则可知铝的质量;
②利用端值法判断;
③当y=8.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则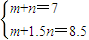 ,解得m=4,n=3.
,解得m=4,n=3.
解答:解:(1)①原料加入冷水无现象表明不含Li、Na等活泼金属;
②原料与盐酸反应产生气体表明含有能与盐酸反应的较活泼的金属;
故答案为:①合金中不含Li、Na等活泼金属;②含有能与盐酸反应的较活泼的金属;
(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀,从而不能吸附镁试剂(I)染料呈天蓝色,
故答案为:错误;若稀盐酸过量,则不产生沉淀,就不能吸附镁试剂(I)染料,检验不出Mg2+;
(3)由图结合题意知该合金含镁、铝(不溶于足量饱和氯化铵溶液的白色沉淀既能溶液盐酸又能溶液氢氧化钠),由于Mg(OH)2可溶于浓的氯化铵溶液,因此用镁试剂(Ⅰ)染料检验Mg2+时要排除NH4+的干扰,所以滤液加入足量氢氧化钠溶液将NH4+转化为NH3,煮沸将氨气赶出,
故答案为:Mg和Al;将NH4+转化为NH3,煮沸促进氨气逸出,防止NH4+干扰Mg2+的检验(或排除溶液中NH4+的干扰);
(4)①镁和铝都能与盐酸反应生成氢气,根据氢气的体积结合合金总质量可确定合金的组成,加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,则可知铝的质量,已知镁的质量和镁铝生成氢气的体积可知铝的质量,则A、B、C都可测定合金的组成,
故答案为:A、B、C;
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,相对分子质量较小的为镁,如x=0,则全被为铝,7mol铝反应生成10.5mol氢气,如全被为镁,即x=7,则生成氢气7mol,则图象为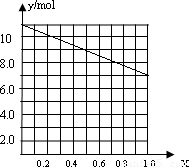 ,
,
故答案为: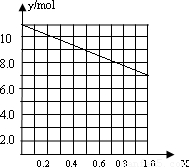 ;
;
③③当y=8.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则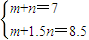 ,解得m=4,n=3,
,解得m=4,n=3,
则化学式为Mg4Al3,
故答案为:Mg4Al3.
点评:本题考查物质含量的测定,侧重于考查学生的实验能力和分析能力,注意根据物质的性质进行判断,题目难度较大.
②能与盐酸反应为较活泼的金属;
(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀;
(3)由题给信息可知Mg(OH)2可溶于浓的氯化铵溶液,应排除NH4+的干扰;
(4)①镁和铝都能与盐酸反应生成氢气,根据氢气的体积结合合金总质量可确定合金的组成,加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,则可知铝的质量;
②利用端值法判断;
③当y=8.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则
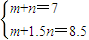 ,解得m=4,n=3.
,解得m=4,n=3.解答:解:(1)①原料加入冷水无现象表明不含Li、Na等活泼金属;
②原料与盐酸反应产生气体表明含有能与盐酸反应的较活泼的金属;
故答案为:①合金中不含Li、Na等活泼金属;②含有能与盐酸反应的较活泼的金属;
(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀,从而不能吸附镁试剂(I)染料呈天蓝色,
故答案为:错误;若稀盐酸过量,则不产生沉淀,就不能吸附镁试剂(I)染料,检验不出Mg2+;
(3)由图结合题意知该合金含镁、铝(不溶于足量饱和氯化铵溶液的白色沉淀既能溶液盐酸又能溶液氢氧化钠),由于Mg(OH)2可溶于浓的氯化铵溶液,因此用镁试剂(Ⅰ)染料检验Mg2+时要排除NH4+的干扰,所以滤液加入足量氢氧化钠溶液将NH4+转化为NH3,煮沸将氨气赶出,
故答案为:Mg和Al;将NH4+转化为NH3,煮沸促进氨气逸出,防止NH4+干扰Mg2+的检验(或排除溶液中NH4+的干扰);
(4)①镁和铝都能与盐酸反应生成氢气,根据氢气的体积结合合金总质量可确定合金的组成,加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,则可知铝的质量,已知镁的质量和镁铝生成氢气的体积可知铝的质量,则A、B、C都可测定合金的组成,
故答案为:A、B、C;
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,相对分子质量较小的为镁,如x=0,则全被为铝,7mol铝反应生成10.5mol氢气,如全被为镁,即x=7,则生成氢气7mol,则图象为
 ,
,故答案为:
 ;
;③③当y=8.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则
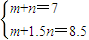 ,解得m=4,n=3,
,解得m=4,n=3,则化学式为Mg4Al3,
故答案为:Mg4Al3.
点评:本题考查物质含量的测定,侧重于考查学生的实验能力和分析能力,注意根据物质的性质进行判断,题目难度较大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究.请完成下列探究报告.
探究目的:探究该焰火原料的组成
资料检索:
①Mg2+检验的方法:取2滴待检液,加入2滴2mol?L-1NaOH溶液,再加入2滴镁试剂(I)染料(对硝基苯偶氮苯二酚).若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有Mg2+.(注:Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+的检测)
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液.
③很多合金是金属互化物,有确定的化学组成.
探究思路:①确定该焰火原料所含金属种类;②测定该火焰原料的化学式.
实验探究:(1)甲同学进行了初步实验,实验步骤和实验现象如下.请填写下表
| 试验序号 | 实验步骤 | 实验现象 | 结论 |
| ① | 取少量该焰火原料, 加入冷水 | 无明显现象 | ______ |
| ② | 取少量该焰火原料, 加入足量稀盐酸 | 完全溶解,有大量气体 产生、溶液呈无色 | ______ |
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下

由丙同学的实验记录可知该焰火原料是由______和______两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸的理由是______.
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成.

问题讨论:

①能确定合金组成的数据组有______(填写选项字母).
A.m、n B.m、y C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol.试在右图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为______.