题目内容
将0.2molMnO2和含0.6molHCl的浓盐酸混合后加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)
| A.等于0.3mol | B.小于0.3mol |
| C.大于0.3mol,小于0.6mol | D.等于0.6mol |
C
试题分析:实验室制取氯气的方程式是MnO2+4HCl(浓)
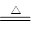 MnCl2+Cl↑+H2O。由于在反应过程中,浓盐酸的浓度逐渐减少,而稀盐酸不能被二氧化锰氧化,所以实际生成的氯气的物质的量小于0.3mol,则溶液中氯离子的物质的量大于0.3mol,因此最终生成的白色沉淀氯化银应该是大于0.3mol,小于0.6mol,答案选C。
MnCl2+Cl↑+H2O。由于在反应过程中,浓盐酸的浓度逐渐减少,而稀盐酸不能被二氧化锰氧化,所以实际生成的氯气的物质的量小于0.3mol,则溶液中氯离子的物质的量大于0.3mol,因此最终生成的白色沉淀氯化银应该是大于0.3mol,小于0.6mol,答案选C。点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识检验对同时,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是明确盐酸浓度的变化,以及二氧化锰和稀盐酸不反应这一关键点,有利于培养学生的逻辑思维能力和 逆向思维能力。

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
