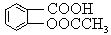题目内容
(1)乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药。乙酰水杨酸的结构简式为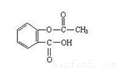 。
。
现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1 mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
①写出乙酰水杨酸与NaOH溶液反应的化学方程式 ;
②计算出产品纯度为 (只需列出计算表达式,不必化简。乙酰水杨酸相对分子质量为180)。
(2)甲醇直接燃料电池具有启动快、效率高、能量密度高等优点。(已知二甲醚直接燃料电池能量密度E =8.39 kW·h·kg-1)。
①若电解质为酸性,甲醇直接燃料电池的负极反应为 ;
②该电池的理论输出电压为1.20 V,能量密度E = (列式计算。能量密度 = 电池输出电能/燃料质量,lkW·h = 3.6×106J,一个电子的电量=1.6×10-19C)。
(1)①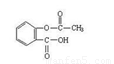 +3NaOH
+3NaOH 
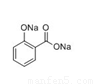 +CH3COONa+2H2O(2分)
+CH3COONa+2H2O(2分)
② 或化简。(2分)
或化简。(2分)
(2)①CH3OH+H2O-6e—=CO2+6H+(2分)
②1Kg甲醇输出的电能:w=UIt=Uq=1.20×1000/32×6×6.02 ×1023×1.602×10-19J
=2.1699×107 J
=2.1699×107/3.6×106kW·h
=6.03 kW·h
甲醇直接燃料电池能量密度E =6.03 kW·h·kg-1(2分)
【解析】
试题分析:乙酰水杨酸与NaOH溶液反应的化学方程式为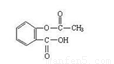 +3NaOH→
+3NaOH→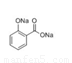 +CH3COONa+2H2O(2分)结合题意计算得产品的纯度为
+CH3COONa+2H2O(2分)结合题意计算得产品的纯度为 ,(2)若电解质为酸性,甲醇直接燃料电池的负极反应为①CH3OH+H2O-6e—=CO2+6H+,1Kg甲醇输出的电能:w=UIt=Uq=1.20×1000/32×6×6.02 ×1023×1.602×10-19J
,(2)若电解质为酸性,甲醇直接燃料电池的负极反应为①CH3OH+H2O-6e—=CO2+6H+,1Kg甲醇输出的电能:w=UIt=Uq=1.20×1000/32×6×6.02 ×1023×1.602×10-19J
=2.1699×107 J
=2.1699×107/3.6×106kW·h
=6.03 kW·h
甲醇直接燃料电池能量密度E =6.03 kW·h·kg-1
考点:有机物的性质、原电池原理。

 心算口算巧算一课一练系列答案
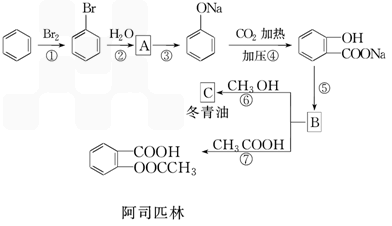
心算口算巧算一课一练系列答案乙酰水杨酸俗称阿司匹林(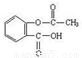 ),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
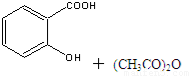

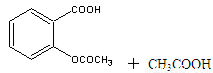
制备基本操作流程如下: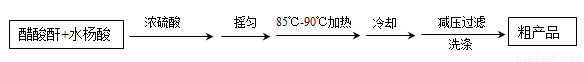
主要试剂和产品的物理常数如下表:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
回答下列问题:
(1)合成阿司匹林时,最合适的加热方法是???????????????????????????? 。
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是???????????????????????? 。
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是????????????????????????? 。
(4)用重结晶方法提纯粗产品流程如下,加热回流程装置如图。

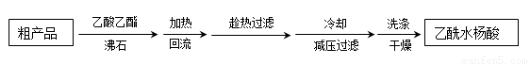
①沸石的作用是?????????????? ;
②冷凝水的流进方向是??????????????? (填“a”或“b”);
③使用温度计的目的是???????????? 。
(5)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(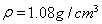 ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为??????????? (百分数精确到0.1)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为??????????? (百分数精确到0.1)。
乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药。合成原理是:

虚框中为提纯原理,是为了除去该反应的副产物:水杨酸酐、乙酰水杨酸水杨酯、乙酰水杨酸酐和聚合物等。水杨酸(熔点158℃)和乙酰水杨酸(熔点135℃)微溶于冷水、可溶于热水和乙酸乙酯。生产流程是:

(1)操作I、III的名称是 ;使用热水浴加热的原因是 。
(2)可以循环利用的是 ;固体2的成份是 。
(3)为了检验产品中是否含有水杨酸,并进行精制(除去产品中的其它反应物和副产物),进行以下操作,请完成下表:
|
序号 |
操作 |
现象 |
结论 |
|
检 验 |
取几粒产品晶体投入装适量热水的试管中,振荡 |
得无色溶液 |
|
|
向试管中滴入 溶液 |
. |
产品中有水杨酸 |
|
|
重 结晶 |
将粗产品溶于适量的水中,水浴加热,趁热过滤,将滤液 ,抽滤 |
有晶体析出 |
精产品 |
(4)用中和法测定产品纯度:
取a g产品溶解于V1 mL1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1 mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;计算出产品纯度为 (只需列出计算表达式,不必化简。乙酰水杨酸分子量为180)。