题目内容
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金。
(1)快中子反应堆的热交换剂用的是钠钾合金,其常温下是????????? 态(填气、液、固)。把钠的物质的量分数为20%的0.2mol的此合金安全地加入到重水(D2O)中,产生的气体物质所含的中子数为???????????? 。
(2)镁铝合金是经常见到的轻质合金。剪一块合金在空气中燃烧,除生成MgO和Al2O3外,最有可能生成的第三种物质的电子式是??????????? 。当一块5.1g的镁铝合金薄片溶于3.6 mol·L-1的200ml 的硫酸溶液中,至少需加入1 mol·L-1的氢氧化钠溶液的体积???????????? mL至沉淀质量不再改变,如整个过程中有0.5mol 的电子发生转移,则合金中Mg的物质的量分数为????? 。
(3)①有一种铜的合金即黄铜(可看作是Cu和Zn),可分别用酸溶法或碱溶法来分离该两种金属,其中把该合金投入到稀盐酸中,发现产生气泡的速度比用锌与盐酸反应制氢气的速度快,其原因是??????????????????????????????????????? 。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图信息推断该合金中除铜外一定含有??????? 。

(1)液??? 0.2NA???? (2)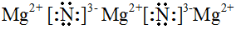 ? 1440;50%
? 1440;50%
(3)①铜锌合金可以形成原电池,加快化学反应速率。 ②Al、Ni
【解析】
试题分析:(1)钠钾合金,其常温下是液态;钠的物质的量分数为20%的0.2mol的此合金中钠和钾的物质的量分别是0.04mol和0.16mol。根据方程式2Na+2H2O=2NaOH+H2↑↑可知,与水反应生成氢气的物质的量分别是0.02mol和0.08mol,共计是0.10mol。由于氢气的组成D2,分子中含有中子数是2个,所以产生的气体物质所含的中子数为0.2NA。
(2)由于镁能与氮气反应生成氮化镁,而空气中含有大量的氮气,所以第三种物质应该是氮化镁,氮化镁是离子化合物,电子式为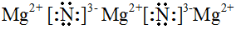 。当沉淀不再发生变化时,此时恰好反应生成氢氧化镁和氢氧化铝沉淀,而溶液中只含有硫酸钠,物质的量是3.6mol/L×0.2L=0.72mol,则关节炎钠离子守恒可知,至少需要氢氧化钠的物质的量是0.72mol×2=1.44mol,其溶液体积为1.44mol÷1.0mol/L=1.44L=1440ml;设合金中Mg、Al的物质的量分别为x和y,则2x+3y=0.5mol、24g/mol×x+27g/mol×y=5.1g,解得x=y=0.1mol,因此合金中Mg的物质的量分数为50%。
。当沉淀不再发生变化时,此时恰好反应生成氢氧化镁和氢氧化铝沉淀,而溶液中只含有硫酸钠,物质的量是3.6mol/L×0.2L=0.72mol,则关节炎钠离子守恒可知,至少需要氢氧化钠的物质的量是0.72mol×2=1.44mol,其溶液体积为1.44mol÷1.0mol/L=1.44L=1440ml;设合金中Mg、Al的物质的量分别为x和y,则2x+3y=0.5mol、24g/mol×x+27g/mol×y=5.1g,解得x=y=0.1mol,因此合金中Mg的物质的量分数为50%。
(3)①由于锌的金属性强于铜,通入到盐酸中,铜锌合金可以形成原电池,加快化学反应速率。
②由图可知,结合题中信息可知开始出现沉淀为Al(OH)3、pH=8.0时过滤除去Ni(OH)2,因此该铜合金中还含Al、Ni。
考点:考查金属、合金的组成与性质、根据方程式进行的有关计算以及溶解平衡的应用

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案