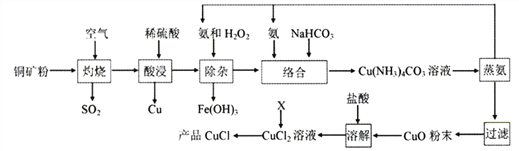
��Ŀ����
����Ŀ��������(AlN)��һ�����ͷǽ������ϣ��������ܻ���ˮ�⡣���������ڵ�����Χ��1700��ϳɣ�����Ϊ��ɫ������ɫ��ĩ��ijС��̽����ʵ�����Ʊ�AlN���ⶨ��Ʒ���ȣ����ʵ�����¡���ش�
(һ)�Ʊ�AlN

(1)�������������ҵķ�������װ�õ���ȷ����˳��Ϊj��__________________��i(�������ӿ���ĸ���)��
(2)ʵ��ʱ���Կ���Ϊԭ���Ʊ�AlN��װ��A�л�ԭ���۵�����Ϊ________________��װ��B���Լ�XΪ_____________________��
(��)�ⶨ��Ʒ����
ȡm g�IJ�Ʒ��������װ�òⶨ��Ʒ��AlN�Ĵ���(�г�װ������ȥ)��
��֪��AlN + NaOH + H2O �� NaAlO2 + NH3��
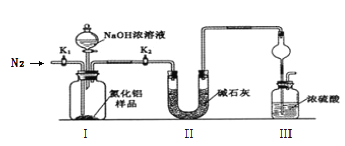
(3)�������ʵ�鲽�裺��װ��ʵ��װ�ã�����_________________________________������ʵ��ҩƷ����������ʵ������ǹر�______________________________����______________���ٴ�Һ©��������������NaOHŨ��Һ��رգ������ٲ������塣��______________��ͨ�뵪��һ��ʱ�䣬�ⶨװ��III��Ӧǰ��������仯Ϊn g��
(4)ʵ����������Ʒ��AlN�Ĵ���Ϊ___________��(�ú�m��n�Ĵ���ʽ��ʾ)��
(5)����ʵ��������Ȼ����ȱ�ݣ�����Ϊ���ܵ�ȱ�ݼ��ᵼ�µIJⶨ���____________(�� ��ƫ��������ƫ��������)���______________________________________________________��
���𰸡�fedcab(��ba)gh(��hg) ����O2 Ũ���� ���װ�õ������� K1 K2 �� K1 ![]() ƫ�� ��������ˮ�����²ⶨ���ƫ��
ƫ�� ��������ˮ�����²ⶨ���ƫ��
��������
��1��AlN�������ܻ���ˮ�⣬�������ڵ�����Χ��1700���ϳɡ���ô���������ȥˮ��O2����ԭ���۳�ȥO2��Bװ����X����Ϊ�˳�ȥˮ��Ӧ��ΪŨ���ᣬCװ�ó�ȥ�����е�CO2��Ӧ����Cװ�ó�ȥCO2������Aװ�ó�ȥO2������ȥˮ������D����Al��Ӧ������ü�ʯ����ֹ��������װ�ã������Ʒ���ʡ���Ϊfedcab(��ba)gh(��hg)��
��2����ԭ���۵����ó�ȥ�����������ʵ��������ţ�Bװ�õ�Ŀ���dz�ȥˮ��XΪŨ���ᣬ��Ϊ����O2 Ũ���
��3��ʵ�鲽�裬��װҩƷ֮ǰ��Ҫ��װ�ý��м�©��ʵ�鿪ʼ���У����Ȳ�ͨ�뵪����K1�ǹرյģ�K2�Ǵģ���Ӧ�����ٲ�������ʱ����Ӧֹͣ����Ҫ�����еİ���ͨ��Ũ�����б����գ������Ҫͨ�뵪������K1����Ϊ���װ�õ������� K1 K2 �� K1��
(4)���ݷ���ʽ
AlN ~ NH3
41 17
m(AlN) n
�ɵ�m(AlN)=![]() ��
��![]() ����Ϊ
����Ϊ![]() ��
��
��5��������Ӧ�м�����ˮ��������������ˮ��ʹ�ð������ܱ�Ũ������ȫ���գ�����������ƫС�����ƫ�͡���Ϊƫ�� ��������ˮ�����²ⶨ���ƫ�͡�