题目内容
16.将AlCl3溶液和NaOH溶液等体积混和得到的沉淀物和溶液中所含的铝元素的质量相等,则原AlCl3溶液和NaOH溶液的物质的量浓度之比可能为( )①1:3 ②2:3 ③1:4 ④2:7.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③- |
分析 将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝可能为AlCl3或NaAlO2,
可分别发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.
解答 解:设AlCl3和NaOH的浓度分别为c1和c2,相同体积为V,
若NaOH过量,生成NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,
又因为得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则说明第一步反应完后,生成的Al(OH)3有一半($\frac{1}{2}$c1V)发生Al(OH)3+OH-=AlO2-+2H2O,
所以可求的NaOH的物质的量为:3c1V+0.5c1V=3.5c1V=c2V,所以c1:c2=2:7;
当氯化铝过量时,氢氧化钠不足,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则c1V-x=x,所以x=0.5c1V,消耗氢氧化钠3x,即1.5c1Vmol,所以1.5c1V=c2V,所以此时c1:c2=2:3.
所以②④符合;
故选B.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意根据题给信息以及反应的相关方程式解答该题,难度中等.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
8.室温时,M(OH)2(S)?M2+(aq)+2OH-(aq) Ksp=a,C(M2+)=b m ol/L时,溶液的pH等于(已知lg2=0.3)( )
| A. | $\frac{1}{2}$lg($\frac{b}{a}$) | B. | 14.3+lgb | C. | 14+$\frac{1}{2}$lg($\frac{a}{b}$) | D. | 14+$\frac{1}{2}$lg($\frac{b}{a}$) |
5.下列情况中属于离子反应的是( )
| A. | H2和O2反应生成了H2O | B. | 盐酸和碳酸钙反应 | ||
| C. | KMnO4加热制O2 | D. | C和O2反应生成CO2 |
6.下列操作正确的是( )
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 称量固体氢氧化钠时应在天平两边托盘上各放一张大小相同的同种质量的纸 | |
| C. | 进行分液时,下层液体从分液漏斗下口流出,上层液体应从上口倒出 | |
| D. | 蒸馏时温度计水银球应位于被蒸馏的液体中 |

 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: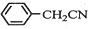 +HO2+H2SO4$\stackrel{100-130℃}{→}$
+HO2+H2SO4$\stackrel{100-130℃}{→}$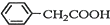 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O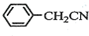 )到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸(
)到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸(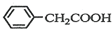 )粗品.加入冷水的目的是便于苯乙酸析出.
)粗品.加入冷水的目的是便于苯乙酸析出.