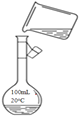
题目内容
【题目】磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
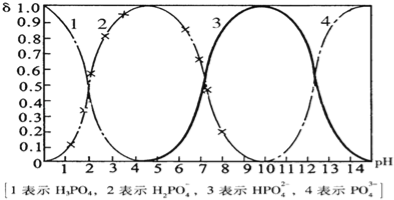
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 .当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是 .
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是 .
(4)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
【答案】(1)c(总)=c(H3PO4)+c(H2PO4﹣)+c(HPO42﹣)+c(PO43﹣)
(2)HPO42﹣+H+═H2PO4﹣ H2PO4﹣、HPO42﹣
(3)酸 H2PO4﹣在溶液中的电离程度大于水解程度
(4)> KOH抑制了PO43﹣的水解
【解析】
试题(1)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,根据P原子守恒,c(总)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-),
(2)根据图象知,当向溶液中滴加稀盐酸时,溶液中H2PO4-增加,HPO42-减少,所以是溶液中的HPO42-和氢离子发生生成H2PO4-,离子方程式为:HPO42-+H+═H2PO4-,当pH=7时,根据图象知,溶液中存在的阴离子为H2PO4-、HPO42-;
(3)根据图象可知,当溶液中存在H2PO4-时,溶液呈酸性,说明H2PO4-在溶液中的电离程度大于水解程度,导致溶液中氢离子浓度大于氢氧根离子的浓度,答案为:酸;H2PO4-在溶液中的电离程度大于水解程度;
(4)磷酸钠是强碱弱酸盐,弱酸根离子能发生水解,导致溶液中c(Na+)/c(PO43-)>3; PO43-+H2O![]() HPO42-+OH-,当向溶液中滴入几滴浓KOH溶液后,水解平衡向逆反应方向移动,所以导致溶液中磷酸根离子的浓度增大,c(Na+)/c(PO43-)的值减小,答案为:>;KOH抑制了PO43-的水解.
HPO42-+OH-,当向溶液中滴入几滴浓KOH溶液后,水解平衡向逆反应方向移动,所以导致溶液中磷酸根离子的浓度增大,c(Na+)/c(PO43-)的值减小,答案为:>;KOH抑制了PO43-的水解.

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O![]() 2HCrO4
2HCrO4![]() 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______性,在强碱溶液中,铬元素的主要存在形式为________(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是 ________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入________________(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______。
【题目】下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A | B | C | D |
配制1mol/L AlCl3溶液 | 实验室制取 氢气 | 比较硫、碳、硅三种 元素的非金属性强弱 | 盛装NaOH 溶液 |
|
|
|
|
A. AB. BC. CD. D