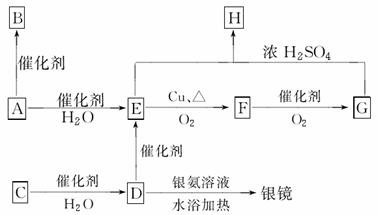
题目内容
实验室里用二氧化锰与浓盐酸反应来制取适量的氯气,反应方程式为MnO2+4HCl(浓)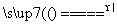 MnCl2+Cl2↑+2H2O。现用100 mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6 L,计算:
MnCl2+Cl2↑+2H2O。现用100 mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6 L,计算:
(1)用双线桥标出电子的转移。
(2)理论上需要参加反应的二氧化锰多少克?
(3)被氧化的HCl的质量为多少克?
解析: n(Cl2)=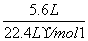 =0.25 mol
=0.25 mol
(2)MnO2+4HCl(浓)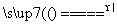 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
87 g 1 mol
m(MnO2) 0.25 mol
87 g∶1 mol=m(MnO2)∶0.25 mol,m(MnO2)=21.75 g
(3)MnO2+4HCl(浓)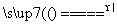 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
73 g 1 mol
m(HCl) 0.25 mol
73 g∶1 mol=m(HCl)∶0.25 mol m(HCl)=18.25 g
被氧化的HCl占参加反应的HCl的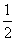 ,则m被氧化(HCl)=9.125 g
,则m被氧化(HCl)=9.125 g
答案: (1) 
(2)21.75 g (3)9.125 g

已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) |
| 乙醇 | —144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | —83.6 | 77.5 | 0.900 |
| 浓硫酸(98%) | — | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。
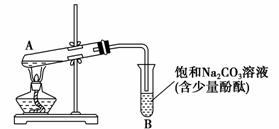
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象________(填选项)。
A.上层液体变薄
B.下层液体红色变浅或变为无色
C.有气体产生
D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:
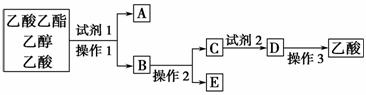
①试剂1最好选用________________________________________________;
②操作1是________,所用的主要仪器名称是________;
③试剂2最好选用________________________________________________;
④操作2是_____________________________________________________;
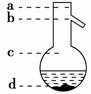
⑤操作3中温度计水银球的位置应为下图中________(填a、b、c、d)所示,在该操作中,除蒸馏烧瓶、温度计外,还需要的玻璃仪器有________、_______、_________、_______,收集乙酸的适宜温度是__________________________。
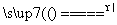 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑ 2H2O+2Cl2
2H2O+2Cl2 .在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀