题目内容
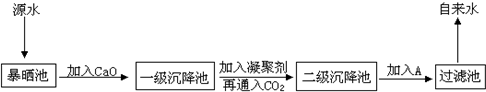
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干复分解反应,试写出其中的一个离子方程式
。
(2)加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是 。
(填写下列各项的序号)
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有化学过程又有物理过程
FeSO4?7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状沉淀是 。
(3)通入二氧化碳的目的是
和
(4)气体A的作用是 。
(5)下列物质中, 可以作为气体A的代替品。(填写下列各项的序号)
①ClO2 ②浓氨水 ③SO2 ④浓硫酸
【解析】联系化工生产与生活实际的题型是高考常考的题型之一,污水的处理尤其重要。
【答案】(1)只要写出下列4个离子方程式中的任意一个,即可给2分。
HCO-3+OH- CO2-3+H2O; Ca2++CO32- CaCO3↓;
Ca2++2HCO-3+2OH- CaCO3↓+CO32-+2H2O;
Mg2++2OH- Mg(OH)2↓
(2)③;Fe(OH)3
(3)除去钙离子;调节溶液酸度
(4)杀菌消毒或氧化性
(5)①

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案(17分)我国规定饮用水质量标准必须符合下列要求:
| PH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |
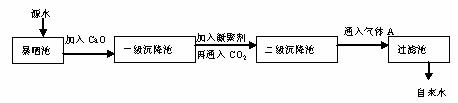
某综合实践活动小组到自来水厂参观,了解到源水处理成自来水的工艺流程示意图如下:
(1)源水中含有Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后发生若干个化学反应,请写出其中任意一个反应的离子方程式:_____________________________________
(2)加入絮凝剂可以除去其中的悬浮固体颗粒,该过程是____________________(填序号)
① 只有物理过程,无化学过程
② 只有化学过程,无物理过程
③ 既有物理过程,又有化学过程
(3)FeSO4·7H2O是常用的絮凝剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是___________(填化学式)
(4)通入二氧化碳的目的是__________和___________。
(5)物质A的作用是_________,则A可以选择下列物质中的__________(填序号)
①ClO2 ②SO2 ③液氯 ④Ca(ClO2)2 ⑤浓硫酸
(17分)我国规定饮用水质量标准必须符合下列要求:
|
PH |
6.5~8.5 |
|
Ca2+、Mg2+总浓度 |
<0.0045mol/L |
|
细菌总数 |
<100个/mL |
某综合实践活动小组到自来水厂参观,了解到源水处理成自来水的工艺流程示意图如下:
 [来源:ZXXK]
[来源:ZXXK]
(1)源水中含有Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后发生若干个化学反应,请写出其中任意一个反应的离子方程式:_____________________________________
(2)加入絮凝剂可以除去其中的悬浮固体颗粒,该过程是____________________(填序号)
① 只有物理过程,无化学过程
② 只有化学过程,无物理过程
③ 既有物理过程,又有化学过程
(3)FeSO4·7H2O是常用的絮凝剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是___________(填化学式)
(4)通入二氧化碳的目的是__________和___________。
(5)物质A的作用是_________,则A可以选择下列物质中的__________(填序号)
①ClO2 ②SO2 ③液氯 ④Ca(ClO2)2 ⑤浓硫酸