题目内容
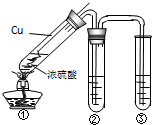
 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )分析:A、SO2为酸性气体,可与碱发生反应;
B、当铜丝与浓硫酸接触时才能反应;
C、根据SO2的漂白性分析;
D、根据溶液颜色的变化判断是否有CuSO4生成.
B、当铜丝与浓硫酸接触时才能反应;
C、根据SO2的漂白性分析;
D、根据溶液颜色的变化判断是否有CuSO4生成.
解答:解:A.SO2为酸性气体,具有污染性,可与碱发生反应,用NaOH溶液吸收多余的SO2,故A正确;
B.当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故B正确;
C.SO2具有漂白性,可用品红溶液验证SO2的生成,故C正确;
D.CuSO4溶液呈蓝色,可依据溶液颜色的变化判断是否有CuSO4生成,故D错误.
故选D.
B.当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故B正确;
C.SO2具有漂白性,可用品红溶液验证SO2的生成,故C正确;
D.CuSO4溶液呈蓝色,可依据溶液颜色的变化判断是否有CuSO4生成,故D错误.
故选D.
点评:本题考查二氧化硫的制备和性质,题目难度不大,注意A项,为制备二氧化硫的简易控制实验方法.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
 (2010?北京)用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合
(2010?北京)用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合 某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应).
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应).
 化学是一门以实验为基础的自然科学.
化学是一门以实验为基础的自然科学.