题目内容
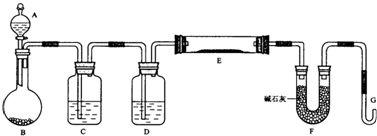
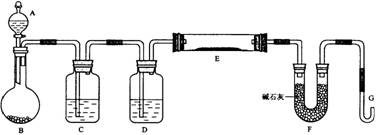
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图。A中的试剂是盐酸。
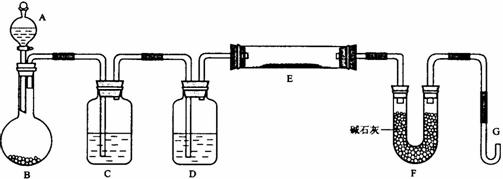
请回答下列问题。
(1)仪器中装入的试剂:B 、C 、D ;
(2)连接好装置后应首先 ,其方法是
;
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 。在这两步之间还应进行的操作是 ;
(4)反应过程中G管逸出的气体是 ,其处理方法是
;
(5)从实验中测得了下列数据
①空E管的质量a
②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量)
④反应前F管及内盛物的总质量d
⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)= ;计算式2:Ar(W)= 。
(1)锌粒 水 浓硫酸
(2)检查气密性
将G弯管浸没在盛有水的烧杯中,温热烧瓶B,观察G管口,若有气泡逸出,说明装置的气密性良好
(3)先从A瓶逐滴滴加液体 检验H2的纯度
(4)氢气 在G管出口处点燃
(5)![]()
![]()
解析:常用HCl与Zn反应制取H2,但制取的H2中常混有杂质氯化氢和水蒸气,在H2与WO3反应前必须依次除去氯化氢、水蒸气,氯化氢极易溶于水,可以用水除去,H2可以用浓硫酸干燥。气密性的检验关键是形成封闭的气体体系,然后调节气体体系的温度,引起压强的变化,进而观察到现象,所以要将G弯管浸没在水中。H2是可燃性气体,加热或点燃可燃性气体以前必须检验气体的纯度,则加热反应管E前,必须用H2排净装置中的空气。H2是尾气,可以用点燃的方法处理。根据H2与WO3反应的化学方程式,要求W的相对原子质量,可以用固体的质量变化,也可以利用生成的H2O的质量求解。
设W的相对原子质量为Ar(W)
3H2+WO3![]() W + 3H2O Δm
W + 3H2O Δm
Ar(W) 54 48
c-a e-d b-c
则Ar(W)=![]() 或者Ar(W)=
或者Ar(W)=![]()

 全能练考卷系列答案
全能练考卷系列答案