题目内容
13.下列各组中的性质比较,不正确的是( )| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 稳定性:NH3<PH3<SiH4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F-<Cl-<Br- |
分析 A.非金属性越强,对应最高价含氧酸的酸性越强;
B.非金属性越强,对应氢化物越稳定;
C.金属性越强,对应最高价氧化物的水化物的碱性越强;
D.非金属性越强,对应阴离子的还原性越弱.
解答 解:A.同周期从左向右非金属性增强,则非金属性Cl>S>P,酸性:HClO4>H2SO4>H3PO4,故A正确;
B.非金属性N>P>Si,则稳定性:NH3>PH3>SiH4,故B错误;
C.金属性K>Na>Mg,则碱性:KOH>NaOH>Mg(OH)2,故C正确;
D.同主族从上到下非金属性减弱,则非金属性F>Cl>Br,可知还原性:F-<Cl-<Br-,故D正确;
故选B.
点评 本题考查元素周期表和周期律,为高频考点,把握元素在周期表的位置、元素的性质、元素周期律为解答关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
20.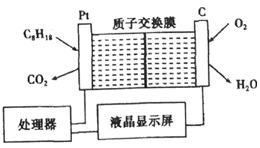 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式为:C8H18+16H2O-50e-═8CO2+50H+ | |
| C. | 每消耗标准状况下5.6 L O2溶液中通过lmol 电子 | |
| D. | H+由质子交换膜左侧向右侧迁移 |
1.H 是一种性能优异的高分子材料,其结构简式为 ,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )
,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )
①加成反应②取代反应③缩聚反应④加聚反应⑤酯化反应.
 ,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )
,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )①加成反应②取代反应③缩聚反应④加聚反应⑤酯化反应.
| A. | ①④⑤ | B. | ①④ | C. | ①②④ | D. | ①②③ |
8.化学反应伴随着能量的变化.下列过程中的能量变化不是由化学反应引起的是( )
| A. | 天然气燃烧 | B. | 中和反应 | ||
| C. | 冰的熔化 | D. | Ba(OH)2•8H2O晶体与氯化铵晶体反应 |
18.下列各组顺序的排列不正确的是( )
| A. | 热稳定性:HCl>H2S>PH3 | |
| B. | 若离子半径:R2->M+,则原子序数一定:R>M | |
| C. | 酸性强弱:H2SiO3<H2CO3<CH3COOH | |
| D. | 熔点:金刚石>食盐>干冰 |
5.已知2H2(g)+CO(g)?CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
| A. | 因该反应为放热反应,故不加热就可发生 | |
| B. | 相同条件下,2 mol H2的能量或1 mol CO的能量一定高于1 mol CH3OH的能量 | |
| C. | 相同条件下,反应物H2和 CO的总能量一定高于生成物CH3OH的总能量 | |
| D. | 达到平衡时,CO的浓度与CH3OH的浓度一定相等 |
2.在2L密闭容器中,发生3A(g)+B(g)?2C(g)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol•Lˉ1•sˉ1,则10秒钟后B的物质的量为( )
| A. | 2.8mol | B. | 1.6mol | C. | 3.2mol | D. | 3.6mol |
3.下列实验方案正确且能达到预期目的是( )
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将H2SO4酸化的H2O2滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2比Fe3+强 |
| B | 将SO2通入酸性高锰酸钾溶液中 | SO2具有漂白性 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(标况) | 测定铝箔中氧化铝的含量 |
| D | 比较不同反应的反应热数据大小 | 判断反应速率大小 |
| A. | A | B. | B | C. | C | D. | D |